
| �� | ���볣����Ka�� | �� | ���볣����Ka�� |
| CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 |
| HClO | 3��10-8 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ױ��л��������ı��ӿ��ü���Ũ��ˮ���˳�ȥ |
| B��ʵ�����������������Թ��м���1.5mLŨ�������μ���2mLŨ�����Ͼ��ȣ���ȴ��50�����£��ڲ������£���μ���1mL������ע�����ʹ�������¶ȳ���60�森���ϴ����ܵ���Ƥ����50�桫60��ˮԡ���� |
| C��CH4�к�������C2H4��ͨ����������KMnO4��Һ��ȥ |
| D�������ˮ���屽��ˮ�����������ˮ�����÷�Һ©������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
| N2 | H2 | NH3 | |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
| �� | 0 | 0 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʾ��A��B���ձ��о�ΪCuCl2��Һ�����������Ա�Ҫ�����Ӳ���գ�
��ͼ��ʾ��A��B���ձ��о�ΪCuCl2��Һ�����������Ա�Ҫ�����Ӳ���գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ʵ������67��ʱ��ij��Ӧ��ϵ��CCl4��Һ�и����ʵ�Ũ����ʱ��ı仯��ͼ����ش��������⣺
ʵ������67��ʱ��ij��Ӧ��ϵ��CCl4��Һ�и����ʵ�Ũ����ʱ��ı仯��ͼ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
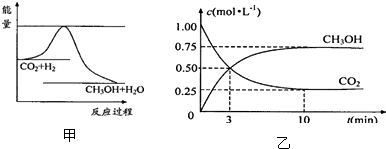
| n(CH3OH) |
| n(CO2) |
| ��� | NaOH��Һ�����/mL | ��������/mL | ��Һ��pH |
| �� | 20.00 | 0.00 | 8 |
| �� | 20.00 | 20.00 | 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��m=4 R2+���������� |
| B��m=y R3+���������� |
| C��m=2 R3+�ǻ�ԭ���� |
| D��m=y R3+�ǻ�ԭ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com