由于温室效应和资源短缺等问题,如何降低大气中的CO
2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO
2生产燃料甲醇.一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),图甲表示该反应进行过程中能量(单位为kJ?mol
-1)的变化.
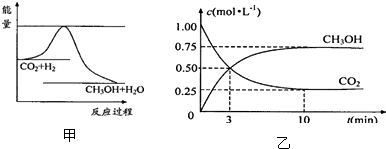
(1)关于该反应的下列说法中,正确的是
.
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为
.
(3)温度降低,平衡常数K
(填“增大”、“不变”或“减小”).
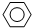
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,测得CO
2和CH
3OH(g)的浓度随时间变化如图乙所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H
2)=
mol?L
-1?min
-1.
(5)下列措施中能使
增大的有
.
A.升高温度; B.加入催化剂; C.将H
2O(g)从体系中分离;
D.再充入1molCO
2和3molH
2; E.充入He(g),使体系总压强增大.
(6)在温度t℃下,某NaOH的稀溶液中c(H
+)=10
-amol/L,c(OH
-)=10
-bmol/L,已知a+b=12,该温度下水的离子积Kw=
;t
25℃(填“大于”、“小于”或“等于”).向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示.
| 序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
20.00 |
0.00 |
8 |
| ② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为
.




 -O-CH2-COOH发生酯化反应的产物.
-O-CH2-COOH发生酯化反应的产物.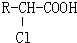 R-ONa
R-ONa
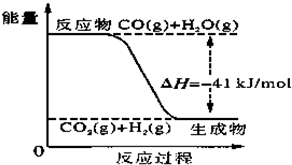 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.