
| A、2HI(g) H2?(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大 |
| B、2NO2(g)?N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅 |
| C、3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加 |
| D、2SO2(g)+O2(g)?2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小 |


科目:高中化学 来源: 题型:
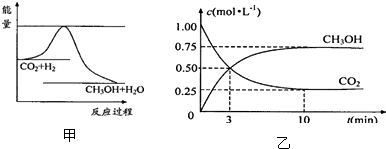
| n(CH3OH) |
| n(CO2) |
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D、浓硝酸试剂瓶口常有白雾,说明浓硝酸有挥发性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL溶液中Ba2+离子浓度为0.4mol?L-1 |
| B、500mL溶液中Cl-离子浓度为0.4mol?L-1 |
| C、500mL溶液中Cl-离子总数为0.4NA |
| D、500mL溶液中Ba2+和Cl-离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W和X位于第二周期 |
| B、Y和Z分别是Al和Si |
| C、W和X分别是O和F |
| D、Z的金属性可能比X的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
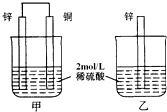 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com