
【题目】胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
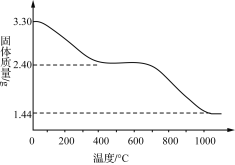
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
【答案】NO 硝酸铜 静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全 > Cu2(OH)2SO4·4H2O
【解析】
(1)制硫酸铜时是用铜与硝酸、硫酸的混合物反应的,生成NO等,可根据反应物判断可能存在的杂质;
(2)在过滤前,需要检验SO42-是否沉淀完全,检验方法是:静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全。
(3)①aCuO·bCuSO4温度在1 000 ℃以上时,得到的固体为Cu2O,生成SO3和O2,由此分析;
②n(Cu2O)=1.44g/144g·mol-1=0.01mol;
n(H2O)=(3.30g-2.40g)/18g·mol-1=0.05mol;
由2.4g固体的组成可视为aCuO·bCuSO4;有2.40g=80g·mol-1a+160g·mol-1b,由铜守恒,a+b=0.02mol,解得a=b=0.01mol;Cux(OH)y(SO4)z·nH2O中x:y:z:n=0.02:0.02:0.01:(0.05-0.02/2)=2:2:1:4。
(1)制硫酸铜时,是用铜与硝酸、硫酸的混合物反应的,生成NO等,铜与硝酸能生成硝酸铜,所以可能混有硝酸铜杂质,化学式为Cu(NO3)2。
(2)在过滤前,需要检验SO42-是否沉淀完全,检验方法是:静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全。
(3)①aCuO·bCuSO4温度在1 000 ℃以上时,得到的固体为Cu2O,生成SO3和O2,温度650~1 000 ℃产生的气体中,n(O)∶n(S)>1:3;
②n(Cu2O)=1.44g/144g·mol-1=0.01mol;
n(H2O)=(3.30g-2.40g)/18g·mol-1=0.05mol;
由2.4g固体的组成可视为aCuO·bCuSO4;有2.40g=80g·mol-1a+160g·mol-1b,由铜守恒,a+b=0.02mol,解得a=b=0.01mol;Cux(OH)y(SO4)z·nH2O中x:y:z:n=0.02:0.02:0.01:(0.05-0.02/2)=2:2:1:4,化学式为Cu2(OH)2SO4·4H2O。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,离子方程式书写正确的是( )
A.向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-=CO2↑+H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH- =2BaSO4↓+AlO2-+2H2O
C.用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.硫酸溶液中滴加足量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
A.常温常压下,14g有N2与CO组成的混合气体含有的原子数目为NA个
B.0.5molO3与11.2LO2所含的分子数一定相等
C.10gCaCO3和KHCO3的固体混合物含有0.1NA个阳离子
D.用16.25gFeCl3制备Fe(OH)3胶体,Fe(OH)3胶体粒子数小于0.1NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~F之间的转化关系如下图所示(部分产物已略去),其中B的相对分子质量是D的2倍。
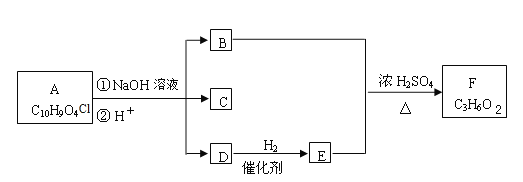
提示:![]() 会自动脱水形成R—CHO。
会自动脱水形成R—CHO。
根据以上信息回答下列问题:
(1)B的分子式是________________。
(2)检验D中官能团可使用的试剂名称是_________,写出D的相邻同系物与该试剂反应的化学方程式_______________________________。
(3)C遇FeCl3溶液显紫色,核磁共振氢谱中有四个峰,其峰面积比为1:2:2:1。写出C的结构简式_______________________。
(4)写出符合下列条件的C的同分异构体的结构简式_______、______、______、________。
①苯环上存在对位取代基;②遇FeCl3溶液显紫色;③能与银氨溶液反应。
(5)写出A的结构简式__________________________。
(6)若1molA和足量NaOH反应,最多能消耗___________mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
(1)写出该反应的平衡常数表达式_____。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件再达平衡后(填“增大”“减小”或“不变”):
①升高温度,CO2的平衡浓度_____,
②再通入CO2,CO2的转化率_____,
③增大容器的体积,混合气体的平均相对分子质量_____。
(3)该反应的逆反应速率随时间变化情况如图:

①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_____(填字母)。
a.升温b.增大CO2的浓度c.使用催化剂d.增压
②如果在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3~t5时间段的v(逆)变化曲线_____。
(4)能判断该反应达到平衡的依据是_____。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是
A. 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管
C. Ni-Zn化合物的纳米颗粒可作![]() 反应的催化剂,提高苯的转化率
反应的催化剂,提高苯的转化率
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)

A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
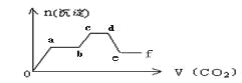
A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com