
【题目】设NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
A.常温常压下,14g有N2与CO组成的混合气体含有的原子数目为NA个
B.0.5molO3与11.2LO2所含的分子数一定相等
C.10gCaCO3和KHCO3的固体混合物含有0.1NA个阳离子
D.用16.25gFeCl3制备Fe(OH)3胶体,Fe(OH)3胶体粒子数小于0.1NA个
【答案】B
【解析】
A. N2与CO的摩尔质量相同都为28g/mol,二者都为双原子分子,14g有N2与CO组成的混合气体物质的量为![]() =0.5mol,含有的原子数目为NA个,故A正确;
=0.5mol,含有的原子数目为NA个,故A正确;
B. 11.2LO2的状态条件未知,无法计算物质的量,与0.5molO3所含的分子数不一定相等,故B错误;
C. CaCO3和KHCO3的摩尔质量相同都为100g/mol,分别含有钙离子和钾离子,10gCaCO3和KHCO3的固体混合物物质的量为![]() =0.1mol,含有0.1NA个阳离子,故C正确;
=0.1mol,含有0.1NA个阳离子,故C正确;
D. 用16.25gFeCl3为![]() =0.1mol,制备Fe(OH)3胶体0.1mol,Fe(OH)3胶体胶粒是由许多Fe(OH)3等小分子聚集一起形成的,微粒数小于0.1NA个,故D正确;
=0.1mol,制备Fe(OH)3胶体0.1mol,Fe(OH)3胶体胶粒是由许多Fe(OH)3等小分子聚集一起形成的,微粒数小于0.1NA个,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为2.25mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有十种物质:①氨水 ②稀硫酸 ③氯化氢 ④NaHSO4 ⑤蔗糖 ⑥二氧化碳 ⑦石墨 ⑧熔融氯化钠 ⑨氢氧化钠 ⑩碳酸钙,请回答下列问题:
(1)属于混合物的是___;属于电解质,但熔融状态下不导电的是___;属于电解质,且难溶于水的是___;属于化合物,但不是电解质的是___;不是电解质,但可以导电的是___;
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___、_____、___;
(3)⑦和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
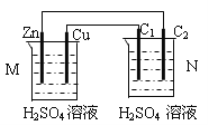
A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 氢气是一种常用的化工原料,应用十分广泛。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。
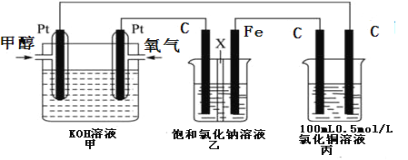
根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:_______________________________________。
(3)装置乙中石墨电极(C)的电极反应式为:_________________________________。
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___________L(标况下);装置乙中溶液的pH为___________(溶液体积为200mL不变),要使乙烧杯中的溶液恢复到原来的状态,需要加入的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。


(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、![]() 、焙烧时间依次分别为_____、_____、_____。
、焙烧时间依次分别为_____、_____、_____。
(2)浸出液“净化除杂”过程如图:

①已知几种氧化剂氧化能力的强弱顺序为:H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择__(填字母)。
A.H2O2 B.Cl2 C.MnO2
②调节pH时,pH可取的范围为______。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
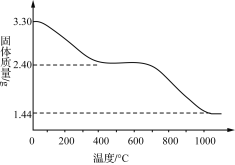
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如图所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
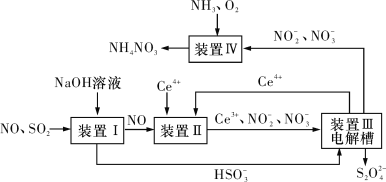
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是![]() 和
和![]() ,请写出生成等物质的量的
,请写出生成等物质的量的![]() 和
和![]() 时的离子方程式:__。
时的离子方程式:__。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的___(填“阳极”或“阴极”),同时在另一极生成![]() 的电极反应式为____。
的电极反应式为____。
(5)已知进入装置Ⅳ的溶液中![]() 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO![]() 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com