
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
【答案】Ba2++OH-+H++SO42- = BaSO4↓+ H2O 10000d/(365+1000V) mol·L-1 18:3:2 CuSO4·H2O 2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-
【解析】
根据物质的性质书写离子方程式;根据气体摩尔体积及物质的量间的关系计算物质的量浓度;根据图象信息结晶水的质量并计算书写化学式;根据电子转移守恒配平书写离子方程式。
(1)沉淀刚好完全时,表示硫酸氢钠用量最少,与Ba2+刚好完全反应,发生的化学方程式为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,转化为离子方程式则为:Ba2++OH-+H++SO42-= BaSO4↓+ H2O;
(2)由题,n(HCl)=V(HCl)/Vm=224L÷22.4L/mol=10mol,m总=m(HCl)+m(H2O)=n(HCl)×M(HCl)+V(H2O)×ρ(H2O)=10×36.5+V×103×1=(365+1000V)g,![]() ,c(HCl)=
,c(HCl)=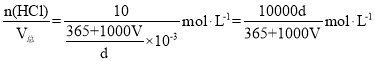 ,故答案为:
,故答案为:![]() ;
;
(3)由题可以写出氯化钠、氯化镁、氯化铝与硝酸银反应的化学方程式:NaCl+AgNO3=AgCl↓+NaNO3,MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2,AlCl3+3AgNO3=3AgCl↓+Al(NO3)3,若假设硝酸银物质的量浓度为1mol/L,氯化钠、氯化镁、氯化铝与硝酸银反应消耗硝酸银体积分别为3L、2L、3L,则氯化钠、氯化镁、氯化铝与硝酸银反应消耗硝酸银物质的量为3mol、2mol、3mol,将三者消耗硝酸银物质的量代入方程式,可以得出氯化钠、氯化镁、氯化铝的物质的量分别为3mol、1mol、1mol,因为三者物质的量浓度之比为1:2:3,可列出等式为:三种溶液的体积之比3/1:1/2:1/3,化简可以得到:三种溶液的体积之比18:3:2,故答案为:18:3:2。
(4)由图可以得知,200℃时,五水合硫酸铜并未脱水完全,分子中还有一定量的水存在,5.00g五水合硫酸铜,物质的量为5g÷250g/mol=0.02mol,所以n(CuSO4)=0.02mol,n(H2O)=0.1mol,200℃时,固体质量为3.56g,所以含有水分质量为0.36g,n(H2O)=m/M=0.36g÷18g/mol=0.02mol,可以得出固体化学式为:CuSO4H2O,故答案为:CuSO4H2O。
(5)由题,根据氧化还原反应得失电子数的规律,可以写出方程式为:7FeI2+8Cl2=2FeCl3+7I2+5FeCl2,转化为离子方程式可得出:2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-,故答案为:2Fe2++14I-+8Cl2 =2Fe3++7I2+16Cl-。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D 四种短周期元素,A 与B 可形成离子化合物BA,BA 中阴阳离子的核外电子排布相同;B 原子最外层只有-个电子;C 元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3;D 原子的质子数是A、B、C 三种原子质子数之和的![]() 。
。
回答下列问题:
(1)写出各元素的元素符号:A____,B____,C____,D____。
(2)写出C1、C2、C3三种核素的原子符号:C1____,C2_____,C3______。
(3)C、D 两种元素形成的微粒X 与化合物BA 中的阳离子所含的质子数和电子数分别相等,则X 的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 氯气与碘化钾溶液反应:Cl2 + I- = Cl- + I2
B. 醋酸除去水垢:2H+ + CaCO3 = Ca2+ + CO2↑ + H2O
C. 铜和浓硝酸反应:Cu + 4H+ + 2NO![]() = Cu2+ + 2NO2↑ + 2H2O
= Cu2+ + 2NO2↑ + 2H2O
D. 二氧化锰与浓盐酸反应:MnO2 + 4H+ + 4Cl- ![]() Mn2+ + 2Cl2↑ + 2H2O
Mn2+ + 2Cl2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A(s)+ 3B(g)![]() 2C(g)+ D(g)来说,下列反应速率最快的是
2C(g)+ D(g)来说,下列反应速率最快的是
A. v(A)=0.3 mol/(Ls) B. v(B)=0.6 mol/(Lmin)
C. v(C)=0.5 mol/(Lmin) D. v(D)=0.01 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
A.常温常压下,14g有N2与CO组成的混合气体含有的原子数目为NA个
B.0.5molO3与11.2LO2所含的分子数一定相等
C.10gCaCO3和KHCO3的固体混合物含有0.1NA个阳离子
D.用16.25gFeCl3制备Fe(OH)3胶体,Fe(OH)3胶体粒子数小于0.1NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体②KHSO4③HNO3④稀硫酸⑤二氧化碳气体⑥铜⑦碳酸钠粉末⑧蔗糖晶体⑨熔融氯化钠⑩CuSO4·5H2O晶体。
请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是___。
(4)②在水溶液中的电离方程式为___,①与②以物质的量之比为1:2在溶液中反应的离子方程式为___。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,还原产物是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
FeO(s)+CO(g),在温度为973 K时,平衡常数K=1.47,在1 173 K时,K=2.15。
(1)写出该反应的平衡常数表达式_____。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件再达平衡后(填“增大”“减小”或“不变”):
①升高温度,CO2的平衡浓度_____,
②再通入CO2,CO2的转化率_____,
③增大容器的体积,混合气体的平均相对分子质量_____。
(3)该反应的逆反应速率随时间变化情况如图:

①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_____(填字母)。
a.升温b.增大CO2的浓度c.使用催化剂d.增压
②如果在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3~t5时间段的v(逆)变化曲线_____。
(4)能判断该反应达到平衡的依据是_____。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①氢氧化钠固体②铜丝③氯化氢气体④稀硫酸⑤二氧化碳气体⑥氨水⑦碳酸氢钠固体⑧蔗糖晶体⑨熔融氢化钠⑩胆矾(C![]() )晶体
)晶体
(1)上述物质相应状态下可导电的是_______________________________。
(2)属于电解质的是_______________________________。
(3)属于非电解质的是_______________________________。
(4)上述状态下的电解质不能导电的是_______________________________。
(5)⑦溶于水后的电离方程式是_______________________________。
(6)①和⑦混合溶于水的离子方程式是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com