
【题目】对反应A(s)+ 3B(g)![]() 2C(g)+ D(g)来说,下列反应速率最快的是
2C(g)+ D(g)来说,下列反应速率最快的是
A. v(A)=0.3 mol/(Ls) B. v(B)=0.6 mol/(Lmin)
C. v(C)=0.5 mol/(Lmin) D. v(D)=0.01 mol/(Ls)
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
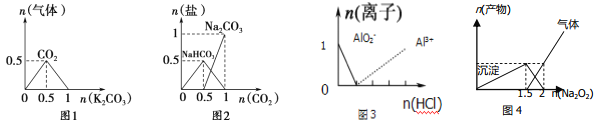
A.图1:n(HCl)=l mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(NaAlO2)=1 mol,HCl加入到NaAlO2溶液中离子的存在情况
D.图4:n(AlCl3)=1 mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷可通过下列反应生成:
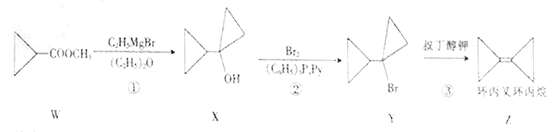
下列说法不正确的是
A. 反应②属于取代反应
B. Z与苯互为同分异构体
C. Z分子中所有碳原子处于同一平面
D. 与W互为同分异构体的链状羧酸类化合物有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有十种物质:①氨水 ②稀硫酸 ③氯化氢 ④NaHSO4 ⑤蔗糖 ⑥二氧化碳 ⑦石墨 ⑧熔融氯化钠 ⑨氢氧化钠 ⑩碳酸钙,请回答下列问题:
(1)属于混合物的是___;属于电解质,但熔融状态下不导电的是___;属于电解质,且难溶于水的是___;属于化合物,但不是电解质的是___;不是电解质,但可以导电的是___;
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___、_____、___;
(3)⑦和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛的合金及其化合物用途非常广泛,回答下列问题:
(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体、准晶体和非晶体。
(2)基态Al原子价电子排布式为____,铝的第一电离能比镁的低,是因为____。
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为____;气态时,氯化铝以双聚体的形式存在,画出Al2Cl6的结构:____。
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是__;H2O2中氧原子的杂化方式是___,H2O2的沸点(158℃)比键合方式相同的S2Cl2(138℃)的高,其原因是____。
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加德罗常数的值为NA,则该铝钛合金的密度为__g·cm-3(列出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
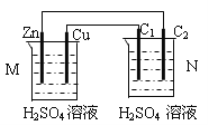
A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。


(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、![]() 、焙烧时间依次分别为_____、_____、_____。
、焙烧时间依次分别为_____、_____、_____。
(2)浸出液“净化除杂”过程如图:

①已知几种氧化剂氧化能力的强弱顺序为:H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择__(填字母)。
A.H2O2 B.Cl2 C.MnO2
②调节pH时,pH可取的范围为______。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com