
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和NaAlO2混合溶液中滴加NaHCO3溶液,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。下列说法不正确的是
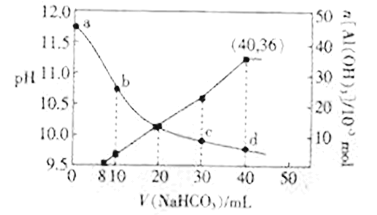
A. 加入的NaHCO3先与NaOH反应
B. b点和c点均有c(Na+)<2c(CO32-)+c(HCO3-)
C. NaHCO3溶液的物质的量浓度为1.125 mol·L-1
D. d点时:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛的合金及其化合物用途非常广泛,回答下列问题:
(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体、准晶体和非晶体。
(2)基态Al原子价电子排布式为____,铝的第一电离能比镁的低,是因为____。
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为____;气态时,氯化铝以双聚体的形式存在,画出Al2Cl6的结构:____。
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是__;H2O2中氧原子的杂化方式是___,H2O2的沸点(158℃)比键合方式相同的S2Cl2(138℃)的高,其原因是____。
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加德罗常数的值为NA,则该铝钛合金的密度为__g·cm-3(列出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质![]() ,而在盐酸中生成浅绿色的
,而在盐酸中生成浅绿色的![]() 溶液。则在
溶液。则在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用双线桥表示此氧化还原反应:![]() _____________________
_____________________
(4)题(2)的反应④中氧化剂与还原剂的物质的量之比为________,若有5 mol还原剂被氧化,则转移的电子数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com