
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质![]() ,而在盐酸中生成浅绿色的
,而在盐酸中生成浅绿色的![]() 溶液。则在
溶液。则在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用双线桥表示此氧化还原反应:![]() _____________________
_____________________
(4)题(2)的反应④中氧化剂与还原剂的物质的量之比为________,若有5 mol还原剂被氧化,则转移的电子数为________。
【答案】![]() 、
、![]() 酸性、氧化性 酸性 氧化性、还原性 还原性、酸性
酸性、氧化性 酸性 氧化性、还原性 还原性、酸性 
![]()
![]()
【解析】
(1)铁钉在氯气中被锈蚀为棕黄色的氯化铁,在盐酸中生成浅绿色的氯化亚铁,铁元素化合价都升高说明铁钉被氯气和氢离子氧化;
(2)①反应Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②反应NaOH+HCl=NaCl+H2O中,没有元素的化合价变化;
③反应2HCl![]() H2↑+Cl2↑中,HCl中H元素的化合价降低,Cl元素的化合价升高;
H2↑+Cl2↑中,HCl中H元素的化合价降低,Cl元素的化合价升高;
④反应2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O中,HCl中部分氯元素的化合价升高,部分氯元素化合价没有变化;
(3)由化学方程式可知,反应中锰元素化合价降低被还原,KMnO4是氧化剂,HCl中氯元素的化合价升高被氧化,HCl是还原剂,反应转移的电子数目为10e—;
(4)由化学方程式可知,2mol的KMnO4被还原,有10molHCl被氧化,转移10mol电子。
(1)铁钉在氯气中被锈蚀为棕黄色的氯化铁,在盐酸中生成浅绿色的氯化亚铁,铁元素化合价都升高说明铁钉被氯气和氢离子氧化,氯气和氢离子具有氧化性,氯离子的为氯元素的最低价态,只有还原性,则氯气、氢离子和氯离子中具有氧化性的是氯气和氢离子,故答案为:Cl2、H+;
(2)①反应Zn+2HCl=ZnCl2+H2↑中,HCl中氢元素的化合价降低,体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②反应NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,HCl表现酸性;故答案为:酸性;
③反应2HCl![]() H2↑+Cl2↑中,HCl中氢元素的化合价降低,氯元素的化合价升高, HCl即表现了氧化性,也表现了还原性,故答案为:氧化性、还原性;
H2↑+Cl2↑中,HCl中氢元素的化合价降低,氯元素的化合价升高, HCl即表现了氧化性,也表现了还原性,故答案为:氧化性、还原性;
④反应2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O中,HCl中部分氯元素的化合价升高,表现了还原性,部分氯元素化合价没有变化生成盐,还表现酸性,故答案为:还原性、酸性;
(3)由化学方程式可知,反应中锰元素化合价降低被还原,KMnO4是氧化剂,HCl中氯元素的化合价升高被氧化,HCl是还原剂,反应转移的电子数目为10e—,用双线桥可表示为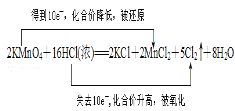 ,故答案为:
,故答案为: ;
;
(4)由化学方程式可知,2mol的KMnO4被还原,有10molHCl被氧化,则氧化剂与还原剂的物质的量之比为1:5,转移10mol电子,若有5 mol还原剂被氧化,转移5mol电子,则转移的电子数为5NA,故答案为:1:5;5NA。


科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A. 《化学与生活》

(1) 营养均衡是保证健康的重要方面。某种食品的配料标签如图所示,根据该食品的配料填空。
①该食品配料中,富含糖类的物质是____。
②该食品配料中,苯甲酸钠的作用是____。
③该食品配料中,碳酸氢钠的作用是____。
(2) 材料是社会经济发展的物质基础。
①钢铁在生活中的应用十分广泛,在潮湿的空气中容易发生____腐蚀。
②普通玻璃的主要成分是Na2SiO3、CaSiO3和 ____(填化学式)。____(填化学式)对玻璃有腐蚀作用,可用于在玻璃仪器上标注刻度及文字。
③聚氯乙烯塑料的结构简式为________,玻璃钢属于________(填“无机非金属材料”“功能高分子材料”或“复合材料”)。
(3)化学与技术的发展是解决环境问题的有效路径。
①减少燃煤产生气体SO2的排放,能够有效控制______(填“硝酸型酸雨”“硫酸型酸雨”或“光化学烟雾”)的形成;向燃煤中加入适量的____(填名称)可减少燃煤烟气中的SO2排放。
②燃煤产生的CO2用氨水吸收可得到氮肥碳铵(NH4HCO3),写出该反应的化学方程式______________。工业上通常采用沉淀法除去废水中的重金属离子,需要控制废水的_____使重金属离子以氢氧化物的形式沉淀出来。
③工业上采用将CO在500 ℃、铝矾催化作用下还原SO2,反应得到两种产物,其中一种产物在常温下是固体。该项技术可大大降低燃煤烟气中SO2的含量,反应的化学方程式为____________________。
B.《有机化学基础》
(1) 有机物的结构决定了其所具有的性质。
①下列有机物不溶于水的是____(填字母)。
a. 乙醛 b. 乙醇 c. 乙酸乙酯
②下列化合物中,不能与新制氢氧化铜悬浊液反应的是____(填字母)。
a. 福尔马林 b. 乙烯 c. 乙酸
③下列试剂中,可用于鉴别苯和甲苯的是____(填字母)。
a. 水 b. 溴水 c. 酸性KMnO4溶液
(2)水杨酸是一种柳树皮提取物,是天然的消炎药,其结构为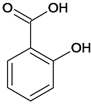 。
。
①水杨酸苯环上的一氯代物有____种。
②水杨酸需密闭保存,其原因是__________。
③水杨酸与足量NaHCO3溶液反应,所得有机产物的结构简式为______。
(3)化合物C是一种医药中间体,由甲苯制备化合物C的路线如下:
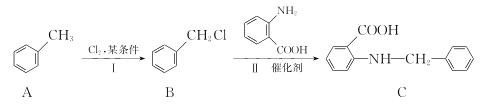
①A→B的反应类型是____。
②B分子中化学环境不同的氢原子有____种。
③D是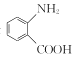 的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
④B→C的反应中能生成化合物E,E和C的相对分子质量相同,写出生成化合物E的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①氢氧化钠固体②铜丝③氯化氢气体④稀硫酸⑤二氧化碳气体⑥氨水⑦碳酸氢钠固体⑧蔗糖晶体⑨熔融氢化钠⑩胆矾(C![]() )晶体
)晶体
(1)上述物质相应状态下可导电的是_______________________________。
(2)属于电解质的是_______________________________。
(3)属于非电解质的是_______________________________。
(4)上述状态下的电解质不能导电的是_______________________________。
(5)⑦溶于水后的电离方程式是_______________________________。
(6)①和⑦混合溶于水的离子方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:

已知:2Na2CO3 + 3H2O2 =2Na2CO3·3H2O2 △H<0
请回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是_________________。
a.MnO2 b.H2S c.稀硫酸 d.NaHCO3
(2)加入NaCl的作用是_________________。
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是_________________。
(4)反应的最佳温度控制在15℃~20℃,温度偏高时造成产率低可能是_________________。
(5)以上流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是_________________。进行该操作的方法是:_________________。
(6)为测定产品的纯度。
准确称取ag产品配成250mL溶液,移取25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释成100mL,作被测试样;用高锰酸钾标准溶液滴定被测试样,MnO4-的还原产物是Mn2+。用cmol/L KMnO4标准溶液VmL滴定待测液,滴定到达终点的现象是________________。
重复滴定三次,平均消耗cmol/L KMnO4标准溶液VmL,则产品中过碳酸钠的质量分数为______________。配制cmol/L KMnO4标准溶液时,移液时有少量液体溅出,则产品的纯度将_________(变大、变小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com