
【题目】现有下列物质:①氢氧化钠固体②铜丝③氯化氢气体④稀硫酸⑤二氧化碳气体⑥氨水⑦碳酸氢钠固体⑧蔗糖晶体⑨熔融氢化钠⑩胆矾(C![]() )晶体
)晶体
(1)上述物质相应状态下可导电的是_______________________________。
(2)属于电解质的是_______________________________。
(3)属于非电解质的是_______________________________。
(4)上述状态下的电解质不能导电的是_______________________________。
(5)⑦溶于水后的电离方程式是_______________________________。
(6)①和⑦混合溶于水的离子方程式是_______________________________。
【答案】②④⑥⑨ ①③⑦⑨⑩ ⑤⑧ ①③⑦⑩ ![]()
![]()
【解析】
①氢氧化钠固体是碱,属于电解质,氢氧化钠固体中没有自由移动的离子,不能导电;
②铜丝属于金属单质,能导电,既不是电解质也不是非电解质;
③氯化氢气体不能导电,溶于水能电离出自由移动的氢离子和氯离子,属于电解质;
④稀硫酸为混合物,溶液中存在自由移动的离子,能导电,混合物既不是电解质也不是非电解质;
⑤二氧化碳气体是酸性氧化物,属于非电解质,不能导电;
⑥氨水为混合物,溶液中存在自由移动的离子,能导电,混合物既不是电解质也不是非电解质;
⑦碳酸氢钠固体是盐,属于电解质,碳酸氢钠固体中没有自由移动的离子,不能导电;
⑧蔗糖晶体是非电解质,不能导电;
⑨熔融氢化钠属于电解质,能电离出自由移动的离子,能导电;
⑩胆矾晶体是盐,属于电解质,胆矾晶体中没有自由移动的离子,不能导电;
(1)铜丝、稀硫酸、氨水熔融氢化钠能导电,故答案为:②④⑥⑨;
(2)氢氧化钠固体、氯化氢气体、碳酸氢钠固体、熔融氢化钠、胆矾晶体属于电解质,故答案为:①③⑦⑨⑩;
(3)二氧化碳气体、蔗糖晶体属于非电解质,故答案为:⑤⑧;
(4)氢氧化钠固体、氯化氢气体、碳酸氢钠固体、胆矾晶体属于电解质,但没有自由移动的离子,不能导电,故答案为:①③⑦⑩;
(5)碳酸氢钠在溶液中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3 =Na++ HCO3-,故答案为:NaHCO3 =Na++ HCO3-;
(6)氢氧化钠和碳酸氢钠在溶液中反应生成碳酸钠和水,反应的离子方程式为HCO3-+2OH-= CO32-+H2O,故答案为:HCO3-+2OH-= CO32-+H2O。


科目:高中化学 来源: 题型:
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下装置图进行实验,填写有关现象及化学方程式。

(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是__________________________,
E中收集的气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质![]() ,而在盐酸中生成浅绿色的
,而在盐酸中生成浅绿色的![]() 溶液。则在
溶液。则在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用双线桥表示此氧化还原反应:![]() _____________________
_____________________
(4)题(2)的反应④中氧化剂与还原剂的物质的量之比为________,若有5 mol还原剂被氧化,则转移的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如图所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
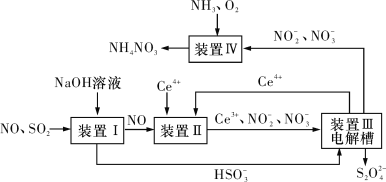
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是![]() 和
和![]() ,请写出生成等物质的量的
,请写出生成等物质的量的![]() 和
和![]() 时的离子方程式:__。
时的离子方程式:__。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的___(填“阳极”或“阴极”),同时在另一极生成![]() 的电极反应式为____。
的电极反应式为____。
(5)已知进入装置Ⅳ的溶液中![]() 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO![]() 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量氢气在氯气中燃烧,所得混合物用![]() 溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新型灭菌消毒剂,实验室通常用以下方法制得该气体:2KClO3+H2C2O4+ H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.1 mol KClO3参与反应转移1 mol电子B.KClO3在该反应中被氧化
C.H2C2O4的还原性强于ClO2D.CO2是氧化产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com