
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
【答案】C
【解析】
A.增大CH3OH的浓度,可使单位体积内活化分子百分数增多,反应速率加快,但活化分子的百分数不变,A错误;
B.此时浓度熵Q=[c(CH3OCH3)×c(H2O)]/c2(CH3OH)=![]() <400,因此反应向正反应方向进行,则正、逆反应速率的大小为v正>v逆,B错误;
<400,因此反应向正反应方向进行,则正、逆反应速率的大小为v正>v逆,B错误;
C. 2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 0.44 0.6 0.6
转化浓度(mol/L) 2x x x
平衡浓度(mol/L) 0.44-2x 0.6+x 0.6+x
则![]() ,解得x=0.2,所此时c(CH3OH)=0.04 mol·L-1,C正确;
,解得x=0.2,所此时c(CH3OH)=0.04 mol·L-1,C正确;
D.根据表中数据可知起始时甲醇的浓度是1.64mol/L,平衡时浓度是0.04mol/L,则0~10min内平均反应速率v(CH3OH)=1.6mol/L÷10min=0.16 mol/(L·min),D错误。
答案选C。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质![]() ,而在盐酸中生成浅绿色的
,而在盐酸中生成浅绿色的![]() 溶液。则在
溶液。则在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用双线桥表示此氧化还原反应:![]() _____________________
_____________________
(4)题(2)的反应④中氧化剂与还原剂的物质的量之比为________,若有5 mol还原剂被氧化,则转移的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】创建文明校园,学校全园禁烟,同学们也参与了“寻找烟头”活动。吸烟有害健康,烟草中的剧毒物尼古丁的结构简式为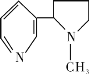 ,有关其叙述正确的是
,有关其叙述正确的是
A. 该有机物属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 尼古丁分子中的六元环不是正六边形
D. 尼古丁的一氯代物有10种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子,某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、AlO2-和SiO32-一定存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新型灭菌消毒剂,实验室通常用以下方法制得该气体:2KClO3+H2C2O4+ H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.1 mol KClO3参与反应转移1 mol电子B.KClO3在该反应中被氧化
C.H2C2O4的还原性强于ClO2D.CO2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.4 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______。
(2)欲用上述浓盐酸和蒸馏水配制500 mL 0.4 mol/L盐酸。
①需量取______mL上述浓盐酸进行配制。
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、_____________。
③用上述浓盐酸配制0.4 mol/L盐酸,定容的操作是_____________________。
(3)配制500 mL 0.4 mol/L盐酸时,下列操作中会导致结果偏低的是____________(填序号)。
a.用量筒量取浓盐酸时仰视量筒的刻度
b.用量筒量取浓盐酸后洗涤量筒,并把洗涤液转入容量瓶中
c.摇匀后发现液面低于刻度线,又加水至刻度线
d.将所配制溶液从容量瓶转移到试剂瓶中时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
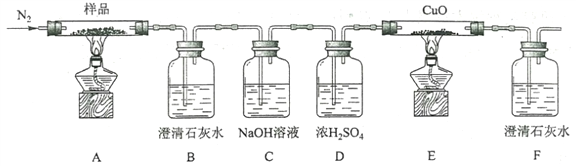
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.等物质的量的NaCl和MgCl2所含Cl-物质的量相等
B.1.7gH2O2中含有电子数为0.9NA
C.常温下,1L0.1mol·L-1的NH4NO3溶液中含氮原子数为0.2NA
D.常温常压下,32gSO2物质的量为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com