
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子,某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、AlO2-和SiO32-一定存在于溶液X中
【答案】B
【解析】
向混合溶液中加入过量的盐酸,有气体生成,可能是CO2或者是SO2,或者均有,则溶液中不存在Mg2+和Al3+,因为会与SO32-、CO32-发生反应而不能大量共存。有沉淀甲生成,在溶液中含有SiO32-,生成硅酸沉淀。加入过量的氨水,生成沉淀,则只有AlO2-与过量的盐酸,生成的Al3+,与氨水反应生成氢氧化铝,由于电荷守恒,一定存在K+。
A.气体甲可能为CO2或者SO2,也可能两个气体成分都有,A项正确,不符合题意;
B.沉淀甲只有硅酸,SiO32-与Mg2+不能大量共存,B项错误,符合题意;
C. AlO2-在过量的盐酸作用下生成Al3+,Al3++3NH3·H2O =Al(OH)3 ↓+ 3NH4+,C项正确,不符合题意;
D.根据分析,D项正确,不符合题意;
本题答案选B。


科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为日常生活中常见的化合物,B为淡黄色固体,C、G、H均为气体,其中C、H为单质,G能使红色石蕊试剂变蓝,E是一种由两种元素组成的具有耐高温、硬度大的耐热冲击材料,其摩尔质量为 41 g/moL。

⑴B的电子式为_____。
⑵E的化学式为_____。
⑶写出反应②的离子方程式(D足量):_____。
⑷写出反应③的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池在生活中的用量很大。酸性锌锰电池(干电池)和碱性锌锰电池的构造如图所示。下列有关说法错误的是( )
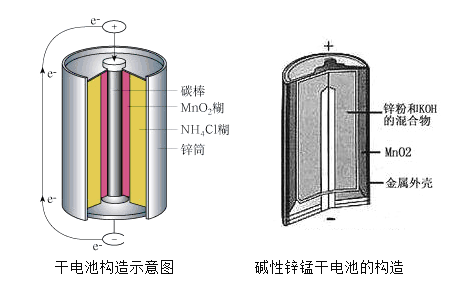
A. 二者分别消耗6.5g锌,都将转移0.2mol电子
B. 二者的正极反应式均为![]()
C. 碱性锌锰电池比酸性锌锰电池比能量高
D. 酸性锌锰电池易发生漏液现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO 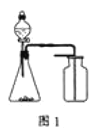
B. 除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干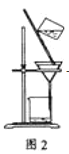
D. 用广泛pH试纸测得0.1molL-1NH4Cl溶液的pH=5.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,固体FeCl3极易潮解,100℃左右时升华。某学习小组利用如图装置(某些夹持仪器略去)制备并收集无水FeCl3固体。请回答:

(1)按气流方向各装置依次连接的合理顺序为__________________(填仪器接口的字母,部分装置可重复使用)。
(2)连接好各装置进行实验,实验步骤如下:检查装置气密性后,装入药品,________(请按正确的顺序填入下列步骤的序号)。
①加热Fe粉反应一段时间②打开分液漏斗活塞通一段时间气体
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)装置F的作用为_____________________,装置E中冷水浴的作用为__________。
(4)写出装置B中所发生反应的化学方程式______________________________。
(5)写出装置D中所发生反应的离子方程式______________________________。
(6)若将装置B中产生的气体通入水中,则发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制NaOH溶液和硫酸溶液。
Ⅰ、配制100mL 1.0mol·L-1 NaOH溶液

(1)如图所示的仪器中E的名称为___,配制溶液肯定不需要的仪器是___(填序号),还需增加的玻璃仪器有___(填仪器名称)。
(2)在配制NaOH溶液时
①根据计算用托盘天平称取NaOH的质量为___g。
②下列操作对所配溶液浓度的影响是(填“偏高”“偏低”“无影响”)。
操作 | 浓度影响 |
用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 | ___ |
没有洗涤烧杯和玻璃棒 | ___ |
定容时,仰视读数 | ___ |
容器E未干燥,残余少量水 | ___ |
Ⅱ、配制100mL 0.5mol·L-1 硫酸溶液
用质量分数为98%,密度为1.84g·cm-3的浓硫酸来配制该溶液,该浓硫酸物质的量浓度为___mol·L-1,所需浓硫酸的体积为___mL (计算结果保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com