
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.等物质的量的NaCl和MgCl2所含Cl-物质的量相等
B.1.7gH2O2中含有电子数为0.9NA
C.常温下,1L0.1mol·L-1的NH4NO3溶液中含氮原子数为0.2NA
D.常温常压下,32gSO2物质的量为0.5mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,属于水解反应的是( )
A. H2O+H2O ![]() H3O++OH-
H3O++OH-
B. HS-+OH- ![]() H2O+S2-
H2O+S2-
C. HS-+H2O ![]() H3O++S2-
H3O++S2-
D. HS-+H2O ![]() H2S+OH-
H2S+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制NaOH溶液和硫酸溶液。
Ⅰ、配制100mL 1.0mol·L-1 NaOH溶液

(1)如图所示的仪器中E的名称为___,配制溶液肯定不需要的仪器是___(填序号),还需增加的玻璃仪器有___(填仪器名称)。
(2)在配制NaOH溶液时
①根据计算用托盘天平称取NaOH的质量为___g。
②下列操作对所配溶液浓度的影响是(填“偏高”“偏低”“无影响”)。
操作 | 浓度影响 |
用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 | ___ |
没有洗涤烧杯和玻璃棒 | ___ |
定容时,仰视读数 | ___ |
容器E未干燥,残余少量水 | ___ |
Ⅱ、配制100mL 0.5mol·L-1 硫酸溶液
用质量分数为98%,密度为1.84g·cm-3的浓硫酸来配制该溶液,该浓硫酸物质的量浓度为___mol·L-1,所需浓硫酸的体积为___mL (计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)( )
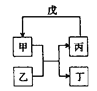
选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
D | Br2 | FeI2 | FeBr3 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥。下列不属于其中的反应的是
A. N2+O2 ![]() 2NOB. 2NO+O2=2NO2
2NOB. 2NO+O2=2NO2
C. 3NO2+H2O===2HNO3+NOD. 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
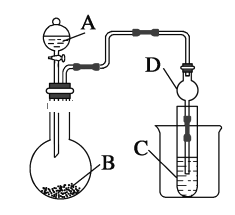
【题目】利用下图装置可以验证非金属性的变化规律。
(1)仪器A的名称为________,球形管D的作用是________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________________________________________。
(3)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com