
【题目】有A、B、C、D 四种短周期元素,A 与B 可形成离子化合物BA,BA 中阴阳离子的核外电子排布相同;B 原子最外层只有-个电子;C 元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3;D 原子的质子数是A、B、C 三种原子质子数之和的![]() 。
。
回答下列问题:
(1)写出各元素的元素符号:A____,B____,C____,D____。
(2)写出C1、C2、C3三种核素的原子符号:C1____,C2_____,C3______。
(3)C、D 两种元素形成的微粒X 与化合物BA 中的阳离子所含的质子数和电子数分别相等,则X 的化学式是________。
【答案】F Na H N ![]()
![]()
![]() NH4+
NH4+
【解析】
B原子最外层只有一个电子,则B为IA族元素,BA中阴阳离子的核外电子排布相同,则A与B为邻周期,B为ⅦA族;C元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3,则C为H,质子数为1 ;则A处于第二周期,B处于第三周期,分别为:F、Na,质子数分别为:9、11,则D的质子数是![]() =7,故D为N,据此分析解答。
=7,故D为N,据此分析解答。
(1)根据分析,A为F,B为Na,C为H,D为N;
(2)根据分析,C为H,质子数为1,三种核素质量数分别为:1、2、3。故三种核素的原子符号:![]() 、
、![]() 、
、![]() ;
;
(3)根据分析,C、D两种元素分别为:H、N,化合物BA为NaF,其中阳离子为Na+,其所含质子数为11,所含电子数为10,则X为H、N元素组成,含10电子的微粒,化学式为NH4+。


科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________;
(4)用电子式表示MgCl2的形成过程 _____________________;
(5)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436 kJ、946 k J、391 k J。则由N2和H2反应生成1 mol NH3 需要放出_____的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
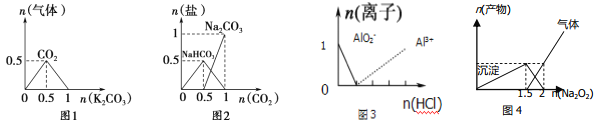
A.图1:n(HCl)=l mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(NaAlO2)=1 mol,HCl加入到NaAlO2溶液中离子的存在情况
D.图4:n(AlCl3)=1 mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为2.25mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷可通过下列反应生成:
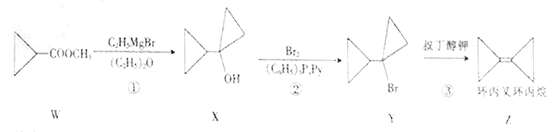
下列说法不正确的是
A. 反应②属于取代反应
B. Z与苯互为同分异构体
C. Z分子中所有碳原子处于同一平面
D. 与W互为同分异构体的链状羧酸类化合物有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________;
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________;

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com