
ΓΨΧβΡΩΓΩIΘ° «βΤχ «“Μ÷÷≥Θ”ΟΒΡΜ·ΙΛ‘≠ΝœΘ§”Π”Ο °Ζ÷ΙψΖΚΓΘ
Θ®1Θ©“‘H2Κœ≥…ΡρΥΊCO(NH2)2ΒΡ”–ΙΊ»»Μ·―ßΖΫ≥Χ Ϋ”–ΘΚ
ΔΌN2(g)ΘΪ3H2(g)===2NH3(g) ΠΛH1ΘΫΘ≠92.4 kJΓΛmolΘ≠1
ΔΎNH3(g)ΘΪ1/2CO2(g)===1/2NH2CO2NH4(s) ΠΛH2ΘΫΘ≠79.7 kJΓΛmolΘ≠1
ΔέNH2CO2NH4(s)===CO(NH2)2(s)ΘΪH2O(l) ΠΛH3ΘΫΘΪ72.5 kJΓΛmolΘ≠1
‘ρN2(g)ΓΔH2(g)”κCO2(g)Ζ¥”Π…ζ≥…CO(NH2)2(s)ΚΆH2O(l)ΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ_______________________________________________________ΓΘ
IIΘ°Ρ≥Ά§―ß…ηΦΤΝΥ“ΜΉιΒγΜ·―ßΉΑ÷Ο»γœ¬ΆΦΥυ ΨΘ§Τδ÷–““ΉΑ÷Ο÷–XΈΣ―τάκΉ”ΫΜΜΜΡΛΘ§ΦΉ¥Φ(CH3OH)ΨΏ”–Ω…»Φ–‘ΓΘ
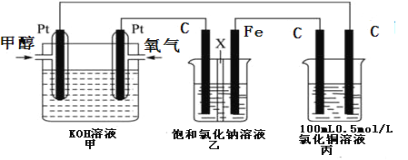
ΗυΨί“Σ«σΜΊ¥πœύΙΊΈ ΧβΘΚ
Θ®2Θ©–¥≥ωΉΑ÷ΟΦΉ÷–ΗΚΦΪΒΡΒγΦΪΖ¥”Π ΫΘΚ_______________________________________ΓΘ
Θ®3Θ©ΉΑ÷Ο““÷– ·ΡΪΒγΦΪΘ®CΘ©ΒΡΒγΦΪΖ¥”Π ΫΈΣΘΚ_________________________________ΓΘ
Θ®4Θ©Β±ΉΑ÷ΟΦΉ÷–œϊΚΡ0.05molO2 ±Θ§±ϊΉΑ÷Ο÷–―τΦΪ≤ζ…ζΤχΧεΒΡΧεΜΐ___________L(±ξΩωœ¬)ΘΜΉΑ÷Ο““÷–»ή“ΚΒΡpHΈΣ___________Θ®»ή“ΚΧεΜΐΈΣ200mL≤Μ±δΘ©Θ§“Σ Ι““…’±≠÷–ΒΡ»ή“ΚΜ÷Η¥ΒΫ‘≠ά¥ΒΡΉ¥Χ§Θ§–η“ΣΦ”»κΒΡΈο÷ «___________ΓΘ
ΓΨ¥πΑΗΓΩN2(g)ΘΪ3H2(g)ΘΪCO2(g)===CO(NH2)2(s)ΘΪH2O(l)ΓΓ ΠΛHΘΫΘ≠179.3 kJΓΛmolΘ≠1 CH3OH -6e+8OH®TCO32+6H2O 2Cl ©¹2e=Cl2Γϋ 1.68 14 HCl
ΓΨΫβΈωΓΩ
IΘ°ΗυΨίΗ«ΥΙΕ®¬…ΦΤΥψΘΜ
IIΘ°ΦΉΉΑ÷Ο «»ΦΝœΒγ≥ΊΘ§ΦΉ¥Φ‘ΎΗΚΦΪΆ®»κΘ§―θΤχ‘Ύ’ΐΦΪΆ®»κΘ§““ΚΆ±ϊΉΑ÷Ο «ΒγΫβ≥ΊΘ§““÷–ΧΦΑτ «―τΦΪΘ§ΧζΒγΦΪ «“θΦΪΘ§±ϊ÷–Ήσ≤ύΧΦΑτ «―τΦΪΘ§”“≤ύΧΦΑτ‘Ύ“θΦΪΘ§ΫαΚœάκΉ”ΒΡΖ≈ΒγΥ≥–ρΓΔΒγΉ”ΒΟ ß ΊΚψΖ÷ΈωΫβ¥πΓΘ
IΘ°Θ®1Θ©“―÷ΣΘΚ
ΔΌN2(g)ΘΪ3H2(g)ΘΫ2NH3(g) ΠΛH1ΘΫΘ≠92.4 kJΓΛmolΘ≠1
ΔΎNH3(g)ΘΪ1/2CO2(g)ΘΫ1/2NH2CO2NH4(s) ΠΛH2ΘΫΘ≠79.7 kJΓΛmolΘ≠1
ΔέNH2CO2NH4(s)ΘΫCO(NH2)2(s)ΘΪH2O(l) ΠΛH3ΘΫΘΪ72.5 kJΓΛmolΘ≠1
‘ρΗυΨίΗ«ΥΙΕ®¬…Ω…÷ΣΔΌ+ΔΎΓΝ2+ΔέΦ¥ΒΟΒΫN2(g)ΓΔH2(g)”κCO2(g)Ζ¥”Π…ζ≥…CO(NH2)2(s)ΚΆH2O(l)ΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣN2(g)ΘΪ3H2(g)ΘΪCO2(g)ΘΫCO(NH2)2(s)ΘΪH2O(l) ΠΛHΘΫΘ≠179.3 kJΓΛmolΘ≠1ΓΘ
IIΘ°Θ®2Θ©»ΦΝœΒγ≥Ί «ΫΪΜ·―ßΡήΉΣ±δΈΣΒγΡήΒΡΉΑ÷ΟΘ§ τ”Ύ‘≠Βγ≥ΊΘ§ΆΕΖ≈»ΦΝœΒΡΒγΦΪ «ΗΚΦΪΘ§ΆΕΖ≈―θΜ·ΦΝΒΡΒγΦΪ «’ΐΦΪΘ§Υυ“‘Ά®»κ―θΤχΒΡΒγΦΪ «’ΐΦΪΘ§ΗΚΦΪ…œΦΉ¥Φ ßΒγΉ”ΚΆ«β―θΗυάκΉ”Ζ¥”Π…ζ≥…ΧΦΥαΗυάκΉ”ΚΆΥ°Θ§ΒγΦΪΖ¥”ΠΈΣCH3OH-6eΘ≠+8OHΘ≠ΘΫCO32Θ≠+6H2OΘΜ
Θ®3Θ©““≥Ί”–ΆβΫ”Βγ‘¥ τ”ΎΒγΫβ≥ΊΘ§ΧζΒγΦΪΝ§Ϋ”‘≠Βγ≥ΊΒΡΗΚΦΪΘ§Υυ“‘ «“θΦΪΘ§‘ρ ·ΡΪΒγΦΪ «―τΦΪΘ§―τΦΪ…œ¬»άκΉ”Ζ≈Βγ…ζ≥…¬»ΤχΘ§ΒγΦΪΖ¥”Π ΫΈΣ2Cl®D®D2eΘ≠ΘΫCl2ΓϋΘΜ
Θ®4Θ©Β±ΉΑ÷ΟΦΉ÷–œϊΚΡ0.05molO2 ±Θ§”…ΒγΦΪΖΫ≥Χ ΫO2+2H2O+4e-ΘΫ4OH-Ω…÷ΣΉΣ“Τ0.2molΒγΉ”Θ§ΉΑ÷Ο±ϊ÷–―τΦΪΒγΦΪΖ¥”ΠΈΣΘΚ2Cl®D®D2eΘ≠ΘΫCl2ΓϋΘ§4OH--4e-ΘΫ2H2O+O2ΓϋΘ§¬»Μ·Ά≠Έο÷ ΒΡΝΩ=0.1LΓΝ0.5mol/L=0.05molΘ§nΘ®Cl-Θ©=0.1molΘ§…ζ≥…¬»ΤχΒγΉ”ΉΣ“Τ0.1molΘ§…ζ≥…¬»ΤχΈο÷ ΒΡΝΩ0.05molΘ§‘ρ«β―θΗυάκΉ”ΒγΫβΖ¥”ΠΒγΉ”ΉΣ“Τ0.1molΘ§…ζ≥…―θΤχ0.025molΘ§…ζ≥…ΤχΧεΈο÷ ΒΡΝΩ=0.05mol+0.025mol=0.075molΘ§±ξΉΦΉ¥Ωωœ¬ΤχΧεΧεΜΐ=0.075molΓΝ22.4L/mol=1.68LΘΜΉΑ÷Ο““÷–“θΦΪΖΔ…ζ2H2O+2e-ΘΫH2+2OH-Θ§Ω…÷Σ…ζ≥…0.2molOH-Θ§»ή“ΚΧεΜΐΈΣ200mLΘ§‘ρcΘ®OH-Θ©=1mol/LΘ§Υυ“‘pH=14Θ§ΒγΫβ±ΞΚΆ¬»Μ·ΡΤ»ή“Κ…ζ≥…«βΤχΚΆ¬»ΤχΘ§“Σ Ι““…’±≠÷–ΒΡ»ή“ΚΜ÷Η¥ΒΫ‘≠ά¥ΒΡΉ¥Χ§Θ§–η“ΣΦ”»κΒΡΈο÷ «HClΓΘ


 ―τΙβΩΈΧΟΩΈ ±”≈Μ·Ής“ΒœΒΝ–¥πΑΗ
―τΙβΩΈΧΟΩΈ ±”≈Μ·Ής“ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Έο÷ ΒΡΉΣΜ·‘ΎΗχΕ®ΧθΦΰœ¬Ρή Βœ÷ΒΡ «Θ® Θ©
ΔΌFe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
ΔΎSiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
ΔέAlCl3![]() Al
Al![]() NaAlO2
NaAlO2
ΔήNa![]() Na2O
Na2O![]() NaOH
NaOH
ΔίSO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
Δό±ΞΚΆNaCl(ag)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
A. ΔΌΔΎΔίB. ΔΎΔέΔόC. ΔΎΔίΔόD. ΔΌΔέΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–ΙΊΈο÷ ΒΡΉΣΜ·ΙΊœΒ»γœ¬ΆΦΥυ Ψ(Ζ¥”ΠΧθΦΰ“―¬‘»Ξ)ΓΘ“―÷ΣΘΚAΈΣΉœΚλ…ΪΫπ τΘ§B ««ΩΥαΘ§EΡή ΙΤΖΚλ»ή“ΚΆ …ΪΘ§F «ΚΘΥ°ΒΡ÷ς“Σ≥…Ζ÷Θ§H «“Μ÷÷Ρ―»ή”ΎΥ°ΒΡΑΉ…ΪΙΧΧεΘ§ΡΠΕϊ÷ ΝΩΈΣ99.5 gΓΛmol-1Θ§I»ή“Κ≥ ΜΤ…ΪΘ§ΙΛ“Β…œΩ…ΉςΈΣ”ΓΥΔΒγ¬ΖΑε ¥ΩΧ“ΚΓΘ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)HΒΡΜ·―ß ΫΈΣ_____ΓΘ
(2)FΒΡΒγΉ” ΫΈΣ_____ΓΘ
(3)–¥≥ωΖ¥”ΠΔΌΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
(4)–¥≥ωΖ¥”ΠΔέΒΡάκΉ”ΖΫ≥Χ Ϋ_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§”Ο0.1000mol/L NaOH»ή“ΚΒΈΕ®20.00mL 0.1000mol/L HCl»ή“ΚΘ§ΒΈΕ®«ζœΏ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
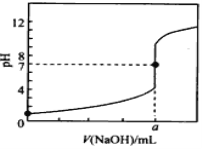
A. a=20.00
B. ΒΈΕ®Ιΐ≥Χ÷–Θ§Ω…Ρή¥φ‘ΎΘΚcΘ®ClΘ≠Θ©ΘΨcΘ®H+Θ©ΘΨcΘ®Na+Θ©ΘΨcΘ®OHΘ≠Θ©
C. »τΫΪ―ΈΥαΜΜ≥…œύΆ§≈®Ε»ΒΡ¥ΉΥαΘ§‘ρΒΈΕ®ΒΫpH=7 ±Θ§aΘΦ20.00
D. »τ”ΟΖ”ΧΣΉς÷Η ΨΦΝΘ§Β±ΒΈΕ®ΒΫ»ή“ΚΟςœ‘”…Έό…Ϊ±δΈΣ«≥Κλ…Ϊ ±ΝΔΦ¥ΆΘ÷ΙΒΈΕ®
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNA±μ ΨΑΔΖϋΌΛΒ¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.≥ΘΈ¬≥Θ―Ιœ¬Θ§14g”–N2”κCOΉι≥…ΒΡΜλΚœΤχΧεΚ§”–ΒΡ‘≠Ή” ΐΡΩΈΣNAΗω
B.0.5molO3”κ11.2LO2ΥυΚ§ΒΡΖ÷Ή” ΐ“ΜΕ®œύΒ»
C.10gCaCO3ΚΆKHCO3ΒΡΙΧΧεΜλΚœΈοΚ§”–0.1NAΗω―τάκΉ”
D.”Ο16.25gFeCl3÷Τ±ΗFe(OH)3ΫΚΧεΘ§Fe(OH)3ΫΚΧεΝΘΉ” ΐ–Γ”Ύ0.1NAΗω
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ“ΜΩιΫπ τΡΤΆΕ»κΒΫΒΈ”–Ήœ…Ϊ ·»ο ‘“ΚΒΡ ΔάδΥ°ΒΡ…’±≠÷–,ΦΉΆ§―ß»œΈΣΩ…Ιέ≤λΒΫœ¬Ν–œ÷œσ,Τδ÷–’ΐ»ΖΒΡ”–( )
ΔΌΡΤΆΕ»κΥ°÷–,œ»≥Ν»κΥ°ΒΉ,ΚσΗΓ≥ωΥ°Οφ
ΔΎΡΤΝΔΦ¥”κΥ°Ζ¥”Π,≤Δ”–ΤχΧε≤ζ…ζ
ΔέΖ¥”ΠΚσ»ή“Κ±δΚλ
ΔήΡΤ»έ≥……ΝΝΝΒΡ–Γ«ρ
Δί–Γ«ρ‘ΎΥ°Οφ…œΥΡ¥Π”ΈΕ·
Δό”–ΓΑΥΜΥΜΓ±ΒΡœλ…υΖΔ≥ω
A. ΔΌΔΎΔέΔή B. ΔΎΔέΔήΔί
C. ΔΎΔήΔίΔό D. ΔέΔήΔό
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–ΜζΈοAΓΪF÷°ΦδΒΡΉΣΜ·ΙΊœΒ»γœ¬ΆΦΥυ ΨΘ®≤ΩΖ÷≤ζΈο“―¬‘»ΞΘ©Θ§Τδ÷–BΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ «DΒΡ2±ΕΓΘ
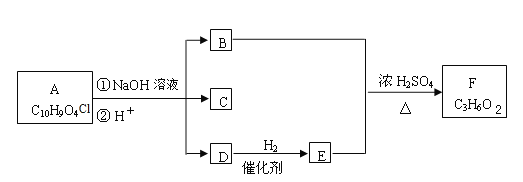
Χα ΨΘΚ![]() ΜαΉ‘Ε·Ά―Υ°–Έ≥…RΓΣCHOΓΘ
ΜαΉ‘Ε·Ά―Υ°–Έ≥…RΓΣCHOΓΘ
ΗυΨί“‘…œ–≈œΔΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©BΒΡΖ÷Ή” Ϋ «________________ΓΘ
Θ®2Θ©Φλ―ιD÷–ΙΌΡήΆ≈Ω… Ι”ΟΒΡ ‘ΦΝΟϊ≥Τ «_________Θ§–¥≥ωDΒΡœύΝΎΆ§œΒΈο”κΗΟ ‘ΦΝΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_______________________________ΓΘ
Θ®3Θ©C”ωFeCl3»ή“Κœ‘Ήœ…ΪΘ§ΚΥ¥≈Ι≤’ώ«βΤΉ÷–”–ΥΡΗωΖεΘ§ΤδΖεΟφΜΐ±»ΈΣ1:2:2:1ΓΘ–¥≥ωCΒΡΫαΙΙΦρ Ϋ_______________________ΓΘ
Θ®4Θ©–¥≥ωΖϊΚœœ¬Ν–ΧθΦΰΒΡCΒΡΆ§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ Ϋ_______ΓΔ______ΓΔ______ΓΔ________ΓΘ
ΔΌ±ΫΜΖ…œ¥φ‘ΎΕ‘ΈΜ»Γ¥ζΜυΘΜΔΎ”ωFeCl3»ή“Κœ‘Ήœ…ΪΘΜΔέΡή”κ“χΑ±»ή“ΚΖ¥”ΠΓΘ
Θ®5Θ©–¥≥ωAΒΡΫαΙΙΦρ Ϋ__________________________ΓΘ
Θ®6Θ©»τ1molAΚΆΉψΝΩNaOHΖ¥”ΠΘ§ΉνΕύΡήœϊΚΡ___________mol NaOHΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß”κ…ζ≤ζ…ζΜνΟή«–œύΙΊΘ§œ¬Ν–”–ΙΊΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A. ΗΜ÷§ ≥ΤΖΑϋΉΑ÷–≥ΘΖ≈»κΜν–‘ΧζΖέ¥ϋΘ§“‘Ζά÷Ι”Ά÷§―θΜ·±δ÷
B. ΡΩ«ΑΩΤ―ßΦ““―Ψ≠÷ΤΒΟΒΞ‘≠Ή”≤ψ’ύΘ§ΤδΒγΉ”«®“Τ¬ «ΙηΒΡ10±ΕΘ§”–Άϊ»Γ¥ζΙη”Ο”Ύ÷Τ‘λΨßΧεΙή
C. Ni-ZnΜ·ΚœΈοΒΡΡ…ΟΉΩ≈ΝΘΩ…Ής![]() Ζ¥”ΠΒΡ¥ΏΜ·ΦΝΘ§ΧαΗΏ±ΫΒΡΉΣΜ·¬
Ζ¥”ΠΒΡ¥ΏΜ·ΦΝΘ§ΧαΗΏ±ΫΒΡΉΣΜ·¬
D. ”ΟK2FeO4¥ζΧφCl2¥Πάμ“ϊ”ΟΥ° ±Θ§Φ»”–…±ΨζœϊΕΨΉς”ΟΘ§”÷”–ΨΜΥ°Ής”Ο
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”Ο»γΆΦΉΑ÷Ο÷Τ»Γ±μ÷–ΒΡΥΡ÷÷Η…‘οΓΔ¥ΩΨΜΒΡΤχΧεΘ®ΆΦ÷–ΧζΦήΧ®ΓΔΧζΦ–ΓΔΦ”»»ΦΑΤχΧε ’Φ·ΉΑ÷ΟΨυ“―¬‘»ΞΘΜ±Ί“Σ ±Ω…“‘Φ”»»ΘΜaΓΔbΓΔcΓΔd±μ Ψœύ”Π“«Τς÷–Φ”»κΒΡ ‘ΦΝΘ©ΓΘΤδ÷–’ΐ»ΖΒΡ «Θ® Θ©

―Γœν | ΤχΧε | a | b | c | d |
A | CO2 | ―ΈΥα | CaCO3 | ±ΞΚΆNa2CO»ή“Κ | ≈®ΝρΥα |
B | Cl2 | ≈®―ΈΥα | MnO2 | NaOH»ή“Κ | ≈®ΝρΥα |
C | NH3 | ±ΞΚΆNH4Cl»ή“Κ | œϊ ·Μ“ | H2O | ΙΧΧεNaOH |
D | NO | œΓœθΥα | Ά≠–Φ | H2O | ≈®ΝρΥα |
A. A B. B C. C D. D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com