
【题目】有关物质的转化关系如下图所示(反应条件已略去)。已知:A为紫红色金属,B是强酸,E能使品红溶液褪色,F是海水的主要成分,H是一种难溶于水的白色固体,摩尔质量为99.5 g·mol-1,I溶液呈黄色,工业上可作为印刷电路板蚀刻液。

请回答下列问题:
(1)H的化学式为_____。
(2)F的电子式为_____。
(3)写出反应①的化学方程式_____。
(4)写出反应③的离子方程式_____。
【答案】CuCl ![]() Cu + 2H2SO4(浓)
Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O CuCl + Fe3+ = Fe2+ + Cu2+ + Cl-
CuSO4 + SO2↑ + 2H2O CuCl + Fe3+ = Fe2+ + Cu2+ + Cl-
【解析】
A为紫红色金属,则应为Cu,B是强酸,E能使品红溶液褪色,则B是浓硫酸,E为SO2,反应①为Cu与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,F是海水的主要成分,F为NaCl,H是一种难溶于水的白色固体,摩尔质量为99.5 g·mol-1,则H应为CuCl,I溶液呈黄色,工业上可作为印刷电路板蚀刻液,则I为FeCl3溶液,以此解答该题。
(1)根据以上分析,H的化学式为CuCl,
因此,本题正确答案是:CuCl;
(2)根据以上分析,F为NaCl,则F的电子式为![]() ,
,
因此,本题正确答案是:![]() ;
;
(3)根据以上分析,反应①为Cu与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,则反应的化学方程式Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O,
CuSO4 + SO2↑ + 2H2O,
因此,本题正确答案是:Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O ;
CuSO4 + SO2↑ + 2H2O ;
(4)根据以上分析,反应③为氯化亚铜和氯化铁溶液发生的氧化还原反应,反应的离子方程式为:CuCl + Fe3+ = Fe2+ + Cu2+ + Cl-,
因此,本题正确答案是:CuCl + Fe3+ = Fe2+ + Cu2+ + Cl-。


科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
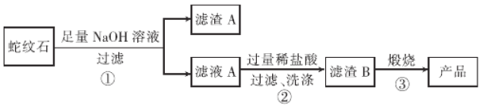
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2↑+9H2O,下列说法正确的是( )
2HNO3+4N2↑+9H2O,下列说法正确的是( )
A. 分解反应都是氧化还原反应B. N2是还原产物,HNO3是氧化产物
C. 被氧化与被还原的氮原子数之比为3∶5D. 每生成4mol N2转移15mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有十种物质:①氨水 ②稀硫酸 ③氯化氢 ④NaHSO4 ⑤蔗糖 ⑥二氧化碳 ⑦石墨 ⑧熔融氯化钠 ⑨氢氧化钠 ⑩碳酸钙,请回答下列问题:
(1)属于混合物的是___;属于电解质,但熔融状态下不导电的是___;属于电解质,且难溶于水的是___;属于化合物,但不是电解质的是___;不是电解质,但可以导电的是___;
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___、_____、___;
(3)⑦和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
SiC+2CO↑(已知SiC中Si元素为+4价),上述反应中还原产物是___;氧化剂与还原剂物质的量之比为___;当有1.12L(标准状况下)CO气体产生时,反应过程中转移的电子数是__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质或物质间反应可能包括多步反应,其总的离子方程式正确的是
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. Na2S投入水中:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 向含1 mol AlCl3溶液中投入4 mol Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-===Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
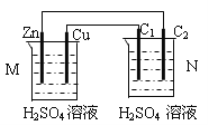
A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 氢气是一种常用的化工原料,应用十分广泛。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。
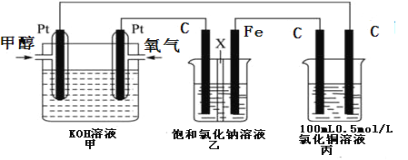
根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:_______________________________________。
(3)装置乙中石墨电极(C)的电极反应式为:_________________________________。
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___________L(标况下);装置乙中溶液的pH为___________(溶液体积为200mL不变),要使乙烧杯中的溶液恢复到原来的状态,需要加入的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X或Na2CO3一次鉴别它们。根据有关操作及所加试剂填空:
(1)现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。推断试剂X为_____。
![]()
(2)现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中,现象为______________,有关反应的离子方程式为____________________。
![]()
(3)现象:有气泡产生,有关反应的离子方程式为________________________,另取该溶液滴入试剂X,则溶液显___________(填“紫色”、“红色”或“蓝色”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com