
����Ŀ��ʵ������ʧȥ��ǩ����ɫ��Һ���Ȼ��ء��������ƺ�ϡ���ᣬ����һ�ֳ������ָʾ��X��Na2CO3һ�μ������ǡ������йز����������Լ���գ�
��1��������Һ����ɫ����ȡ����Һ����Na2CO3��Һ�У������������ƶ��Լ�XΪ_____��
![]()
��2��������Һ����ɫ����ȡ����Һ����Na2CO3��Һ�У�����Ϊ______________,�йط�Ӧ�����ӷ���ʽΪ____________________��
![]()
��3�����������ݲ������йط�Ӧ�����ӷ���ʽΪ________________________����ȡ����Һ�����Լ�X������Һ��___________�����ɫ��������ɫ������ɫ������
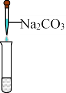
���𰸡���ɫʯ����Һ �а�ɫ�������� CO32+Ca2+��CaCO3�� CO32+2H+��H2O+CO2�� ��ɫ
��������
��1��������Һ����ɫʯ����Һ����ɫ��
��2��������Һ��ʹ��ɫʯ����Һ����ɫ���������ƺ�Na2CO3��Һ��Ӧ����̼��Ƴ������������ƣ�
��3��������һ���ᣬ����ʯ����Һ�Ժ�ɫ���ܺ�̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ��������̼��
(1)�Ȼ��ء��������ƺ�ϡ����������Һ�У���Һ����ɫ��˵���μ�ʯ�ӦΪ������ҺKCl���Ȼ�����̼���Ʋ���Ӧ���ʴ�Ϊ����ɫʯ����Һ��
(2)������Һ����������ʹ��ɫʯ����Һ����ɫ�������������ƺ�Na2CO3��Һ��Ӧ����̼��Ƴ������������ƣ�ʵ���ǣ�CO32+Ca2+��CaCO3����
(3)������һ���ᣬ��ʯ����Һ�Ժ�ɫ������������ֻ�������ܺ�̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ��������̼����Ӧ�����ӷ���ʽΪCO32+2H+��H2O+CO2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
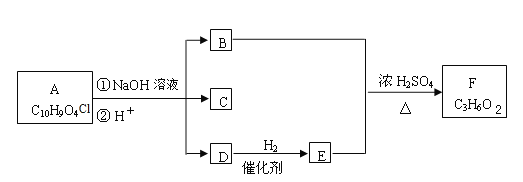
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(��Ӧ��������ȥ)����֪��AΪ�Ϻ�ɫ������B��ǿ�ᣬE��ʹƷ����Һ��ɫ��F�Ǻ�ˮ����Ҫ�ɷ֣�H��һ��������ˮ�İ�ɫ���壬Ħ������Ϊ99.5 g��mol-1��I��Һ�ʻ�ɫ����ҵ�Ͽ���Ϊӡˢ��·��ʴ��Һ��

��ش��������⣺
(1)H�Ļ�ѧʽΪ_____��
(2)F�ĵ���ʽΪ_____��
(3)д����Ӧ�ٵĻ�ѧ����ʽ_____��
(4)д����Ӧ�۵����ӷ���ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��F֮���ת����ϵ����ͼ��ʾ�����ֲ�������ȥ��������B����Է���������D��2����
��ʾ��![]() ���Զ���ˮ�γ�R��CHO��
���Զ���ˮ�γ�R��CHO��
����������Ϣ�ش��������⣺
��1��B�ķ���ʽ��________________��
��2������D�й����ſ�ʹ�õ��Լ�������_________��д��D������ͬϵ������Լ���Ӧ�Ļ�ѧ����ʽ_______________________________��
��3��C��FeCl3��Һ����ɫ���˴Ź������������ĸ��壬��������Ϊ1:2:2:1��д��C�Ľṹ��ʽ_______________________��
��4��д����������������C��ͬ���칹��Ľṹ��ʽ_______��______��______��________��
�ٱ����ϴ��ڶ�λȡ����������FeCl3��Һ����ɫ��������������Һ��Ӧ��
��5��д��A�Ľṹ��ʽ__________________________��
��6����1molA������NaOH��Ӧ�����������___________mol NaOH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����������������أ������й�˵������ȷ����
A. ��֬ʳƷ��װ�г�����������۴����Է�ֹ��֬��������
B. Ŀǰ��ѧ���Ѿ��Ƶõ�ԭ�Ӳ��࣬�����Ǩ�����ǹ��10��������ȡ�����������쾧���
C. Ni-Zn�����������������![]() ��Ӧ�Ĵ�������߱���ת����
��Ӧ�Ĵ�������߱���ת����
D. ��K2FeO4����Cl2��������ˮʱ������ɱ���������ã����о�ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijNa2CO3��NaAlO2�Ļ����Һ����μ���1molL1�����ᣬ�����Һ�е�CO32��HCO3��AlO2��Al3+�����ʵ��������������Һ������仯��ϵ��ͼ��ʾ��������˵����ȷ���ǣ� ������֪��H2CO3�ĵ���ƽ�ⳣ��K1 = 4.3��107,K2 = 5.6��1011��Al(OH)3����ʽ����ƽ�ⳣ��K=6.3��1013��

A. a���߱�ʾ�����ӷ���ʽΪ��AlO2+4H+ = Al3+ + 2H2O
B. M��ʱ���ɵ�CO2Ϊ0.05 mol
C. ԭ�����Һ�е�CO32��AlO2�����ʵ���֮��Ϊ1:2
D. V1:V2=1:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����������������������ȷ���ǣ� ��
A.��״���£�![]() ���еķ�����Ϊ
���еķ�����Ϊ![]()
B.���³�ѹ�£�![]() ����ˮ�γɵ���Һ�к���
����ˮ�γɵ���Һ�к���![]() ������Ϊ
������Ϊ![]()
C.ͨ��״���£�![]() ��
��![]() ����ռ�е����Ϊ22.4 L
����ռ�е����Ϊ22.4 L
D.���ʵ���Ũ��Ϊ![]() ��
��![]() ��Һ�У�����
��Һ�У�����![]() ����Ϊ
����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӽ���ķ�����ȷ���ǣ� ��
A.ij��Һ�м���������Һ���ɰ�ɫ������˵��ԭ��Һ����![]()
B.ij��Һ�м�![]() ��Һ���ɰ�ɫ������˵��ԭ��Һ����
��Һ���ɰ�ɫ������˵��ԭ��Һ����![]()
C.ij��Һ�м�NaOH��Һ������ɫ������˵��ԭ��Һ����![]()
D.ij��Һ�м�ϡ������Һ������ɫ��ζ���壬˵��ԭ��Һ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ����ȡ���е����ָ�����������壨ͼ������̨�����С����ȼ������ռ�װ�þ�����ȥ����Ҫʱ���Լ��ȣ�a��b��c��d��ʾ��Ӧ�����м�����Լ�����������ȷ���ǣ� ��

ѡ�� | ���� | a | b | c | d |
A | CO2 | ���� | CaCO3 | ����Na2CO��Һ | Ũ���� |
B | Cl2 | Ũ���� | MnO2 | NaOH��Һ | Ũ���� |
C | NH3 | ����NH4Cl��Һ | ��ʯ�� | H2O | ����NaOH |
D | NO | ϡ���� | ͭм | H2O | Ũ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
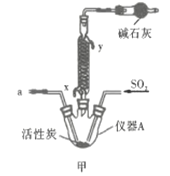
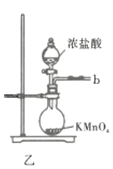
����Ŀ�������ȣ�![]() ��������Ϊ��ɫҺ�壬�۵�-54.1�棬�е�69.l�棬100�����ϻ�ʱ�����ֽ⣬�ڳ�ʪ�����С����̡����������л���ѧ���Ȼ�������ҩ���Ⱦ�ϵ���ȡ��Ҳ����Ҫ���á�ʵ�����п��ø���������Ͷ��������ڻ���̿������ȡ�����ȣ�
��������Ϊ��ɫҺ�壬�۵�-54.1�棬�е�69.l�棬100�����ϻ�ʱ�����ֽ⣬�ڳ�ʪ�����С����̡����������л���ѧ���Ȼ�������ҩ���Ⱦ�ϵ���ȡ��Ҳ����Ҫ���á�ʵ�����п��ø���������Ͷ��������ڻ���̿������ȡ�����ȣ�![]()
![]() ��ʵ��װ����ͼ��ʾ�����ּг�װ��δ��������
��ʵ��װ����ͼ��ʾ�����ּг�װ��δ��������
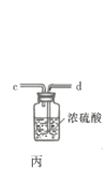
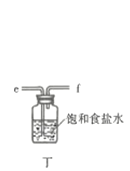
�ش��������⣺
��1������A������Ϊ___________�����������������ҵķ�������װ�ýӿ�����˳��Ϊ___________��
��2������������������ȴˮ�������___________���x����y�������������ʢװ��ʯ�ҵ�����Ϊ___________��
��3�����ڴ�ŵ������Ȼᷢ�ƣ���ԭ�����Ϊ______________________��
��4��![]() �ڳ�ʪ�����С����̡�����Ӧ�Ļ�ѧ����ʽΪ______________________��
�ڳ�ʪ�����С����̡�����Ӧ�Ļ�ѧ����ʽΪ______________________��
��5����ҵ���Ƶõ������ȳ��������������ʣ����õζ����ⶨ�䴿�ȣ���ȡ1.500g��Ʒ�����뵽ʢ��100mL 0.5000 mol![]() ��Һ���ձ��м��ȳ�ַ�Ӧ����ȴ��ת����250mL___________�У�����___________����ҡ�����ݡ�ҡ�ȣ����Ƶõ�������Һ��ȡ25.00mL������Һ����ƿ�У��μ�2�μ��ȣ���0.1000
��Һ���ձ��м��ȳ�ַ�Ӧ����ȴ��ת����250mL___________�У�����___________����ҡ�����ݡ�ҡ�ȣ����Ƶõ�������Һ��ȡ25.00mL������Һ����ƿ�У��μ�2�μ��ȣ���0.1000![]() ����Һ�ζ�������ζ��յ������Ϊ___________���ظ��ζ����Σ�ƽ�����ı���Һ10.00mL����ø���Ʒ�Ĵ���Ϊ___________��
����Һ�ζ�������ζ��յ������Ϊ___________���ظ��ζ����Σ�ƽ�����ı���Һ10.00mL����ø���Ʒ�Ĵ���Ϊ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com