
【题目】硫酰氯(![]() )常温下为无色液体,熔点-54.1℃,沸点69.l℃,100℃以上或长时间存放易分解,在潮湿空气中“发烟”。可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。实验室中可用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯:
)常温下为无色液体,熔点-54.1℃,沸点69.l℃,100℃以上或长时间存放易分解,在潮湿空气中“发烟”。可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。实验室中可用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯:![]()
![]() ,实验装置如图所示(部分夹持装置未画出):
,实验装置如图所示(部分夹持装置未画出):
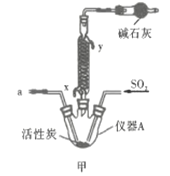
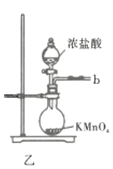
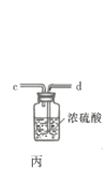
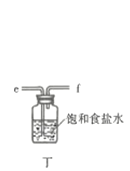
回答下列问题:
(1)仪器A的名称为___________;按氯气气流从左到右的方向,合理的装置接口连接顺序为___________。
(2)甲中蛇形冷凝管冷却水的入口是___________(填“x”或“y”),干燥管中盛装碱石灰的作用为___________。
(3)长期存放的硫酰氯会发黄,其原因可能为______________________。
(4)![]() 在潮湿空气中“发烟”,反应的化学方程式为______________________。
在潮湿空气中“发烟”,反应的化学方程式为______________________。
(5)工业上制得的硫酰氯常混有硫酸盐杂质,可用滴定法测定其纯度:称取1.500g样品,加入到盛有100mL 0.5000 mol![]() 溶液的烧杯中加热充分反应,冷却后转移至250mL___________中,经过___________、轻摇、定容、摇匀,配制得到待测溶液。取25.00mL待测溶液于锥形瓶中,滴加2滴甲基橙,用0.1000
溶液的烧杯中加热充分反应,冷却后转移至250mL___________中,经过___________、轻摇、定容、摇匀,配制得到待测溶液。取25.00mL待测溶液于锥形瓶中,滴加2滴甲基橙,用0.1000![]() 标准溶液滴定,到达滴定终点的现象为___________;重复滴定三次,平均消耗标准溶液10.00mL,测得该样品的纯度为___________。
标准溶液滴定,到达滴定终点的现象为___________;重复滴定三次,平均消耗标准溶液10.00mL,测得该样品的纯度为___________。
【答案】三颈(口)烧瓶 befdca x 吸收尾气,并防止空气中水蒸气进入三颈烧瓶 硫酰氯分解产生的少量氯气溶解在其中 SO2Cl2+2H2O═H2SO4+2HCl 容量瓶 洗涤(或洗涤并转移) 滴加一滴标准溶液后,锥形瓶中溶液由黄色变为橙色,且30s内不恢复 90.00%
【解析】
(1)根据装置图判断仪器A名称;按照氯气的制取、除杂、干燥连接仪器;
(2)冷凝管中冷却水低进高出,碱石灰吸收氯气、二氧化硫,防止水蒸气进入三颈烧瓶;
(3)硫酰氯(![]() )长时间存放易分解产生氯气;
)长时间存放易分解产生氯气;
(4)![]() 在潮湿空气中水解为硫酸和氯化氢;
在潮湿空气中水解为硫酸和氯化氢;
(5)根据配制250mL一定浓度的溶液回答;1.500g硫酰氯样品水解生成的硫酸和盐酸与0.05mol氢氧化钠反应,剩余的氢氧化钠与盐酸发生反应。
(1)根据装置图,仪器A名称是三颈(口)烧瓶;按氯气的制取、除杂、干燥,仪器连接顺序是b→ e→ f →d → c→a;
(2)冷凝管中冷却水低进高出,冷却水的入口是x;碱石灰吸收氯气、二氧化硫等尾气,并防止空气中水蒸气进入三颈烧瓶;
(3)硫酰氯分解产生的少量氯气溶解在硫酰氯,所以长期存放的硫酰氯会发黄;
(4)![]() 在潮湿空气中水解为硫酸和氯化氢,反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl;
在潮湿空气中水解为硫酸和氯化氢,反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl;
(5)称取1.500g样品,加入到盛有100mL 0.5000 mol![]() 溶液的烧杯中加热充分反应,冷却后转移至250mL容量瓶中,经过洗涤、轻摇、定容、摇匀,配制得到待测溶液,根据题意,所得溶液呈碱性,滴加2滴甲基橙溶液呈黄色;用0.1000
溶液的烧杯中加热充分反应,冷却后转移至250mL容量瓶中,经过洗涤、轻摇、定容、摇匀,配制得到待测溶液,根据题意,所得溶液呈碱性,滴加2滴甲基橙溶液呈黄色;用0.1000![]() 标准溶液滴定,到达滴定终点的现象为滴加一滴标准溶液后,锥形瓶中溶液由黄色变为橙色,且30s内不恢复;1.500g硫酰氯样品水解生成的硫酸和盐酸与0.05mol氢氧化钠反应,剩余的氢氧化钠与盐酸发生反应。1.500g硫酰氯样品水解生成溶液中n(H+)=0.1L× 0.5mol/L-0.01L× 0. 1mol/L×10=0.04mol;根据SO2Cl2+2H2O═H2SO4+2HCl,n(SO2Cl2)=
标准溶液滴定,到达滴定终点的现象为滴加一滴标准溶液后,锥形瓶中溶液由黄色变为橙色,且30s内不恢复;1.500g硫酰氯样品水解生成的硫酸和盐酸与0.05mol氢氧化钠反应,剩余的氢氧化钠与盐酸发生反应。1.500g硫酰氯样品水解生成溶液中n(H+)=0.1L× 0.5mol/L-0.01L× 0. 1mol/L×10=0.04mol;根据SO2Cl2+2H2O═H2SO4+2HCl,n(SO2Cl2)=![]() 0.01mol,m(SO2Cl2)= 0.01mol× 135g/mol=1.35g,样品的纯度是
0.01mol,m(SO2Cl2)= 0.01mol× 135g/mol=1.35g,样品的纯度是![]() 90%。
90%。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】实验室有失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X或Na2CO3一次鉴别它们。根据有关操作及所加试剂填空:
(1)现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。推断试剂X为_____。
![]()
(2)现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中,现象为______________,有关反应的离子方程式为____________________。
![]()
(3)现象:有气泡产生,有关反应的离子方程式为________________________,另取该溶液滴入试剂X,则溶液显___________(填“紫色”、“红色”或“蓝色”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或现象描述正确的是( )

A. 实验室用图1装置制备Cl2
B. 加热后图2中溶液颜色恢复红色
C. 用图3装置除去Cl2中含有的少量HCl
D. 实验室用图4装置制取少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用单线桥标出电子转移___________________________
(2)还原剂是__________,被还原的元素是__________,还原产物是__________。
(3)若生成2mol的NO气体,溶液中生成的Cu2+为___________mol。
(4)在反应中硝酸显示_________性和____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
选项 | 目的 | 实验 |
A | 检验某品牌食盐是否为加碘盐 | 将样品溶解后滴加淀粉溶液 |
B | 检验补铁剂硫酸亚铁片是否部分氧化 | 取样品溶解于水,滴加铁氰化钾溶液 |
C | 鉴别葡萄糖溶液和蔗糖溶液 | 分别取样,滴加银氨溶液,水浴加热 |
D | 证明 | 将 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有足量A的容积固定的密闭容器中加入B,发生反应:A(s)+2B(g) 4C(g)+D(g) ΔH<0。一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示。其他条件不变,下列措施能使θ值增大的是( )

A. 降低温度B. 增大压强C. 加入催化剂D. 再加入少量A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应:Fe + S == FeS 2Fe + 3Cl2 ==2FeCl3 3Fe + 2O2 ==Fe3O4 则 S,Cl2,O2 的氧化性:______>_____ >______
(2)用双线桥标出下列反应中电子转移的方向和数目:______
MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应中的氧化剂是________,HCl体现的性质是_______________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱图显示有三组峰,则A的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
(1)某同学用含钠元素的不同类别物质制备NaCl。请再列举3种反应:
①2Na+Cl2![]() 2NaCl
2NaCl
②___;
③___;
④___。
(2)粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①写出MgCl2、CaSO4的电离方程式:___、___。
②各操作分别是:操作a___、操作b___、操作c___。
③试剂Ⅰ是___。
④加入试剂Ⅱ所发生的离子方程式为___,加入试剂Ⅲ所发生的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com