
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱图显示有三组峰,则A的结构简式为__________。
【答案】CaCl2 不能 将装置中的空气排尽,否则会因空气中含有二氧化碳和水蒸气而影响测定结果的准确性 N(C):N(H):N(O)=2:6:1 CH3CH2OH
【解析】
有机物完全氧化为CO2和H2O,先用氯化钙吸收水蒸气,再用氢氧化钠吸收二氧化碳,来测定生成的CO2、H2O的量,根据其中含有的C、H质量和与有机物A质量大小判断有机物质中是否含有O元素,若含有O元素,计算出O原子物质的量,来确定实验式,即确定有机物的最简式,若最简式中H原子已经饱和C原子的四价结构,则最简式就是分子式,否则需要知道有机物相对分子质量来确定分子式。有机物A的核磁共振氢谱有3个吸收峰,说明分子中含有3种H原子,据此分析解答。
(1)因为固体氢氧化钠能同时吸收CO2和H2O,导致无法确定生成H2O和CO2的质量,所以要先用氯化钙吸收水蒸气,再用氢氧化钠吸收二氧化碳,因此甲、乙中的吸收剂不能颠倒;
(2)实验开始时,要先通入氧气一会儿,将装置中的空气排尽,然后再加热,否则会因空气中含有二氧化碳和水蒸气而影响测定结果的准确性;
(3)生成水的物质的量n(H2O)=5.4g÷18g/mol=0.3mol,n(H)=2n(H2O)=0.6mol;生成二氧化碳的物质的量n(CO2)=8.8g÷44g/mol=0.2mol,n(C)=n(CO2)=0.2mol,氧原子的物质的量n(O)=(4.6g-0.6g-0.2mol×12g/mol)÷16g/mol=0.1mol,故有机物A中N(C):N(H):N(O)=0.2:0.6:0.1=2:6:1;
(4)由于有机物A中N(C):N(H):N(O)=2:6:1,最简式为C2H6O,在最简式中H原子已经饱和碳的四价结构,则有机物分子式为C2H6O,由于有机物A的核磁共振氢谱有3个吸收峰,说明分子结构中含有3种不同环境的H原子,故有机物A的结构简式为CH3CH2OH。


科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(![]() )常温下为无色液体,熔点-54.1℃,沸点69.l℃,100℃以上或长时间存放易分解,在潮湿空气中“发烟”。可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。实验室中可用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯:
)常温下为无色液体,熔点-54.1℃,沸点69.l℃,100℃以上或长时间存放易分解,在潮湿空气中“发烟”。可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。实验室中可用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯:![]()
![]() ,实验装置如图所示(部分夹持装置未画出):
,实验装置如图所示(部分夹持装置未画出):
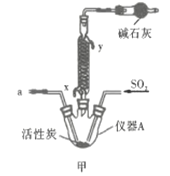
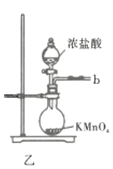
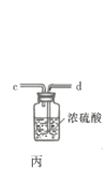
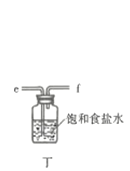
回答下列问题:
(1)仪器A的名称为___________;按氯气气流从左到右的方向,合理的装置接口连接顺序为___________。
(2)甲中蛇形冷凝管冷却水的入口是___________(填“x”或“y”),干燥管中盛装碱石灰的作用为___________。
(3)长期存放的硫酰氯会发黄,其原因可能为______________________。
(4)![]() 在潮湿空气中“发烟”,反应的化学方程式为______________________。
在潮湿空气中“发烟”,反应的化学方程式为______________________。
(5)工业上制得的硫酰氯常混有硫酸盐杂质,可用滴定法测定其纯度:称取1.500g样品,加入到盛有100mL 0.5000 mol![]() 溶液的烧杯中加热充分反应,冷却后转移至250mL___________中,经过___________、轻摇、定容、摇匀,配制得到待测溶液。取25.00mL待测溶液于锥形瓶中,滴加2滴甲基橙,用0.1000
溶液的烧杯中加热充分反应,冷却后转移至250mL___________中,经过___________、轻摇、定容、摇匀,配制得到待测溶液。取25.00mL待测溶液于锥形瓶中,滴加2滴甲基橙,用0.1000![]() 标准溶液滴定,到达滴定终点的现象为___________;重复滴定三次,平均消耗标准溶液10.00mL,测得该样品的纯度为___________。
标准溶液滴定,到达滴定终点的现象为___________;重复滴定三次,平均消耗标准溶液10.00mL,测得该样品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
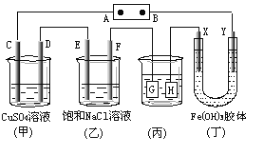
A. 电源B极是正极
B. 装置(丁)中X极附近红褐色变深,说明氢氧化铁胶粒带正电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)一块表面已被氧化为Na2O的钠块10.8 g,将其投入100 mL水中,产生标准状况下2.24 L气体(假设溶液体积变化可忽略)。则这块钠块中所含单质钠的质量分数是_________(保留小数点后一位)。所得溶液中溶质的物质的量浓度为_________。
(2)已知实验室也可用KMnO4和浓盐酸反应制备氯气,化学方程式为2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O,请用双线桥法表示出电子转移的方向和数目______________。该反应中还原产物为______________。
(3)碳酸氢钠俗称小苏打,请写出碳酸氢钠的电离方程式_______________________。碳酸氢钠既能与酸反应又能与碱反应,请写出碳酸氢钠溶液与NaOH溶液反应的离子方程式
_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
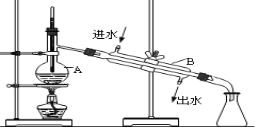
(1)装置中仪器A、B的名称是_____________________ 、 ______________________。
(2)请指出上图中的两处明显错误:____________________、_____________________。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含氢原子为0.2×6.02×1024个的NH4HCO3,其质量是___,其中含氧原子的物质的量为___。3.6克水中含有质子数为___(阿伏伽德罗常数为NA)。
(2)现实验室要用12mol·L-1氢氧化钠溶液来配制浓度为0.6mol·L-1的稀氢氧化钠溶液100mL,则需要这种浓碱的体积是___mL。需要用托盘天平称量___克氢氧化钠才能配制成0.5mol·L-1的氢氧化钠溶液100mL。
(3)将标况下aLHCl气体溶于配制成1L盐酸溶液,所得溶液密度为dg/cm3,则所得溶液物质的量浓度为___mol/L,该溶液中溶质的质量分数为___。
(4)在标准状况下,某气体A的密度是1.25g·L-1,则它的摩尔质量是___,同温同压下该气体相对于氢气的密度是___;在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合气体的平均相对分子质量是___,混合物中CO和CO2物质的量之比是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com