
【题目】如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
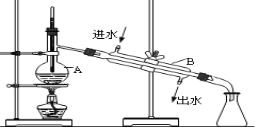
(1)装置中仪器A、B的名称是_____________________ 、 ______________________。
(2)请指出上图中的两处明显错误:____________________、_____________________。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是_____________。
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作或现象描述正确的是( )

A. 实验室用图1装置制备Cl2
B. 加热后图2中溶液颜色恢复红色
C. 用图3装置除去Cl2中含有的少量HCl
D. 实验室用图4装置制取少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应:Fe + S == FeS 2Fe + 3Cl2 ==2FeCl3 3Fe + 2O2 ==Fe3O4 则 S,Cl2,O2 的氧化性:______>_____ >______
(2)用双线桥标出下列反应中电子转移的方向和数目:______
MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
该反应中的氧化剂是________,HCl体现的性质是_______________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱图显示有三组峰,则A的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )

A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
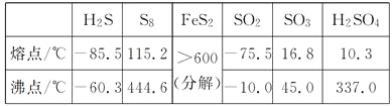
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
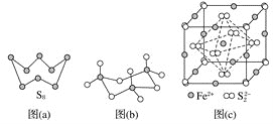
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
(1)某同学用含钠元素的不同类别物质制备NaCl。请再列举3种反应:
①2Na+Cl2![]() 2NaCl
2NaCl
②___;
③___;
④___。
(2)粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①写出MgCl2、CaSO4的电离方程式:___、___。
②各操作分别是:操作a___、操作b___、操作c___。
③试剂Ⅰ是___。
④加入试剂Ⅱ所发生的离子方程式为___,加入试剂Ⅲ所发生的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com