
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
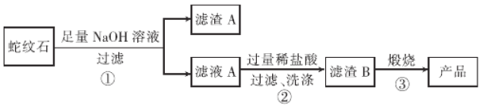
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
【答案】Na2O、K2O SiO2+2OH-=SiO32-+H2O MgO和Fe2O3 向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复操作2至3次 H2SiO3![]() SiO2+H2O 坩埚钳、三脚架
SiO2+H2O 坩埚钳、三脚架
【解析】
蛇纹石(含SiO2、MgO、Na2O、K2O、Fe2O3)加入足量氢氧化钠进行碱浸溶解,SiO2可与氢氧化钠反应生成硅酸钠,Na2O、K2O可与氢氧化钠溶液中的水反应生成氢氧化钠和氢氧化钾;MgO、Fe2O3不与氢氧化钠溶液反应,也不溶于水,则滤渣A为MgO、Fe2O3,滤液A主要含有K+、Na+、OH-、SiO32-,加入过量盐酸中和滤液A中的碱,同时SiO32-在酸性条件下转化为H2SiO3沉淀,经过滤、洗涤,得到滤渣B为H2SiO3,对其煅烧分解生成SiO2,据此分析解答。
(1)根据分析,蛇纹石中含有的可溶性金属氧化物有Na2O和K2O,它们能与水反应生成氢氧化钠和氢氧化钾;
(2)二氧化硅属于酸性氧化物,可与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(3)氧化钠与氧化钾属于可溶性氧化物,氧化铝属于两性氧化物,二氧化硅属于酸性氧化物,上述四种物质都能溶解在氢氧化钠溶液中,氧化镁和氧化铁属于碱性氧化物且难溶于水,因此,滤渣A的成分有MgO和Fe2O3;
(4)步骤②生成沉淀的成分是硅酸,洗涤过滤出的沉淀的方法是:向过滤器中注入蒸馏水至浸没沉淀,待水自然流出后,重复上述操作两到三次;
(5)步骤③用灼烧的方法使硅酸分解生成二氧化硅,化学方程式为:H2SiO3![]() SiO2+H2O,实验室灼烧固体时需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、坩埚钳和三脚架。
SiO2+H2O,实验室灼烧固体时需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、坩埚钳和三脚架。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
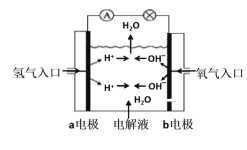
①下列叙述不正确的是___。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
②若电解质溶液为KOH溶液,则电极反应式为:a极__,b极___。
(2)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。回答下列问题:
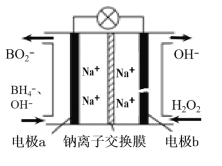
①电池放电时Na+移动方向是:__(填“从左向右”或“从右向左”)。
②电极b采用MnO2,MnO2的作用是__。
③该电池的负极反应为:__。
④每消耗3molH2O2,转移的电子数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末可能是Cu、Cu2O、Fe2O3中的一种或几种。为探究其组成,称取a g该固体粉末样品,用过量的稀硫酸充分反应后(已知:Cu2O+2H+=Cu2++Cu+H2O),称得固体质量为b g。则下列推断不合理的是
A. 反应后溶液中大量存在的阳离子最多有3种
B. 向反应后的溶液中加入一定量的NaNO3,可能使b g固体完全溶解
C. 若b=![]() a,则红色固体粉末一定为纯净物
a,则红色固体粉末一定为纯净物
D. b的取值范围:0<b≤a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )

A. B、D的原子序数之差可能为2
B. E、B的原子序数之差可能是8、18或32
C. 5种元素的核电荷总数之和可能为5a+10
D. A、E的原子序数之差可能是7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:
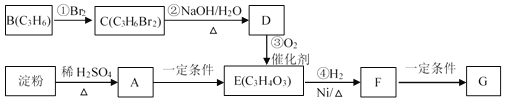
已知:CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
请回答下列问题:
(1)物质A的分子式为_______,B的结构简式为_______;
(2)请写出F中含氧官能团的名称_______;
(3)反应①~④中属于加成反应的是_______;
(4)写出由F生成聚合物G的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=______。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____(填“A” 或“B ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
②SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
③AlCl3![]() Al
Al![]() NaAlO2
NaAlO2
④Na![]() Na2O
Na2O![]() NaOH
NaOH
⑤SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
⑥饱和NaCl(ag)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
A. ①②⑤B. ②③⑥C. ②⑤⑥D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(反应条件已略去)。已知:A为紫红色金属,B是强酸,E能使品红溶液褪色,F是海水的主要成分,H是一种难溶于水的白色固体,摩尔质量为99.5 g·mol-1,I溶液呈黄色,工业上可作为印刷电路板蚀刻液。

请回答下列问题:
(1)H的化学式为_____。
(2)F的电子式为_____。
(3)写出反应①的化学方程式_____。
(4)写出反应③的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com