
【题目】某红色固体粉末可能是Cu、Cu2O、Fe2O3中的一种或几种。为探究其组成,称取a g该固体粉末样品,用过量的稀硫酸充分反应后(已知:Cu2O+2H+=Cu2++Cu+H2O),称得固体质量为b g。则下列推断不合理的是
A. 反应后溶液中大量存在的阳离子最多有3种
B. 向反应后的溶液中加入一定量的NaNO3,可能使b g固体完全溶解
C. 若b=![]() a,则红色固体粉末一定为纯净物
a,则红色固体粉末一定为纯净物
D. b的取值范围:0<b≤a
【答案】C
【解析】
根据题意红色固体粉末可能存在六种组成。
1、若a g红色固体粉末只有Cu,加入过量的稀硫酸不反应。称得固体质量b g即为铜的质量,因此b=a,此时溶液中只含有氢离子和硫酸根离子;
2、若a g红色固体粉末为Cu和Fe2O3的混合物,加入过量的稀硫酸与Cu不反应,与Fe2O3反应生成硫酸铁溶液,铜和硫酸铁溶液发生氧化还原反应:Cu + 2Fe3+ == Cu2+ + 2Fe2+,若称得固体质量b g即为原混合物中铜反应后剩余的质量,因此b<a,此时溶液中含有氢离子和硫酸根离子、二价铁离子和铜离子;
3、若a g红色固体粉末为Cu和Cu2O,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量的稀硫酸生成铜和硫酸铜溶液,称得固体质量b g即为原样品中的铜的质量加上Cu2O反应生成的铜的质量,因此b<a,此时溶液中只含有氢离子、硫酸根离子和铜离子;
4、若a g红色固体粉末只有Fe2O3,加入过量的稀硫酸与Fe2O3反应生成硫酸铁溶液,反应后无固体剩余,因此b=0,此时溶液中只含有氢离子和硫酸根离子;
5、若a g红色固体粉末只有Cu2O,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量的稀硫酸生成铜和硫酸铜溶液,称得固体质量b g即为Cu2O反应生成的铜的质量,因此b<a,此时溶液中只含有氢离子、硫酸根离子和铜离子;
6、若a g红色固体粉末为Cu2O和Fe2O3,加入过量的稀硫酸与Fe2O3反应生成硫酸铁溶液,与Cu2O反应生成铜和硫酸铜溶液,铜和硫酸铁溶液发生氧化还原反应:Cu + 2Fe3+ == Cu2+ + 2Fe2+,若称得固体质量b g即为Cu2O反应生成的铜再次反应后剩余的质量,因此b<a,此时溶液中含有氢离子以及硫酸根离子、铜离子、二价铁离子;
A. 根据上述分析,反应后溶液中大量存在的阳离子最多有3种,故A正确。
B. 不论以何种形式组成的红色固体,反应后若有固体剩余,一定是铜。由于硫酸过量,向反应后的溶液中加入一定量的NaNO3,形成硝酸,具有氧化性,可与铜反应,只要硝酸足够,可能使反应产生的固体完全溶解,故B正确
C. 若b=![]() a,即b<a,根据上述分析,红色固体粉末可能的组合为Cu和Fe2O3的混合物;Cu和Cu2O的混合物;只有Cu2O;Cu2O和Fe2O3的混合物,因此红色固体粉末可能是混合物也可以是纯净物,故C错误;
a,即b<a,根据上述分析,红色固体粉末可能的组合为Cu和Fe2O3的混合物;Cu和Cu2O的混合物;只有Cu2O;Cu2O和Fe2O3的混合物,因此红色固体粉末可能是混合物也可以是纯净物,故C错误;
D. 根据上述六种红色固体粉末组成的分析,b的取值范围:0<b≤a,故D正确。
答案选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1 mol·L1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
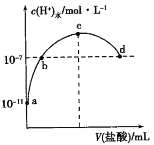
A. 常温下,0.1 mol·L1氨水中NH3·H2O的电离常数K约为1×10-6
B. a、b之间的点一定满足:c(NH4+) > c(Cl) > c(H+) > c(OH)
C. b、d点溶液中都满足c(NH4+)=c(Cl)
D. c点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:
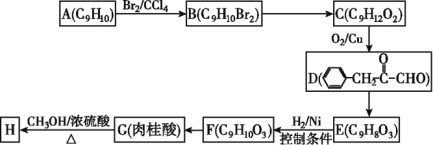
请回答下列问题:
(1)化合物A的结构简式为_____________,D中含有官能团的名称为_________________。
(2)B→C所加试剂的名称是______________,F→G的反应类型为__________。
(3)G→H的化学方程式为______________________________。
(4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
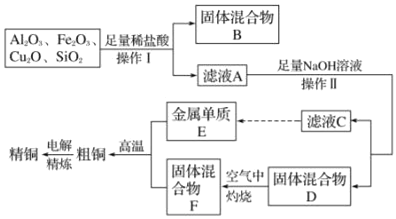
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____。它与NaOH溶液反应的离子方程式为_____。
(2)滤液A中铁元素的存在形式为_____(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____。要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
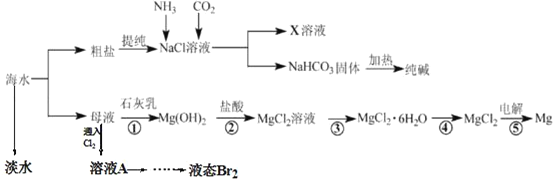
(1)从海水中获得淡水的装置如图,其中有_____处错误。

(2)在母液中通入氯气的离子方程式为_____,从溶液A中提取Br2,需要的主要仪器是____
(3)操作③是_____
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的_____溶液、NaOH溶液、_____溶液;
c._____;
d.加适量盐酸;
e._____(请补全缺少的试剂和实验步骤)
②步骤b中,加入最后一种试剂发生反应的离子方程式为_____
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
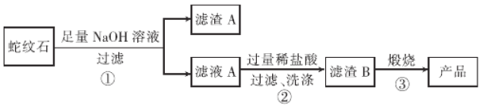
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com