
����Ŀ���ؽ��ij������ڹؽڻ�Һ���γ������ƾ�������NaUr����ƽ���ϵΪ��Ur��(aq)+Na+(aq) ![]() NaUr(s)������Ur����ʾ��������ӡ�ҽ���������ؽ��ײ���Ҫע�Ᵽů���ر����ֽŵ��������Զ�IJ�λ����Ϊ��һ�ιؽ��ķ���������ָ���ֺ�Ĺؽڴ�����˵��
NaUr(s)������Ur����ʾ��������ӡ�ҽ���������ؽ��ײ���Ҫע�Ᵽů���ر����ֽŵ��������Զ�IJ�λ����Ϊ��һ�ιؽ��ķ���������ָ���ֺ�Ĺؽڴ�����˵��
A. �γ������ƾ���ķ�ӦΪ���ȷ�Ӧ B. �γ������ƾ���ķ�ӦΪ���ȷ�Ӧ
C. �������ܽ�Ƚϴ� D. �����ƾ���һ��������ˮ
���𰸡�A
��������
A.��Ϊ���ؽ��ij������ڹؽڻ�Һ���γ������ƾ��塱 �롰�ؽ��ײ���Ҫע�Ᵽů����˵���ؽ��������ڶ���������֪�����¶ȣ�ʹUr-(aq)+Na+(aq)![]() NaUr(s)ƽ��������Ӧ�����ƶ���������������ԭ�����÷�ӦΪ���ȷ�Ӧ��A����ȷ��
NaUr(s)ƽ��������Ӧ�����ƶ���������������ԭ�����÷�ӦΪ���ȷ�Ӧ��A����ȷ��
B.��A�������֪�γ������ƾ���ķ�ӦΪ���ȷ�Ӧ��B�����
C. ���ݡ��ؽ��ij������ڹؽڻ�Һ���γ������ƾ��塱����֪����Һ�д����ܽ�ƽ��NaUr(s)![]() Ur-(aq)+Na+(aq)����Ȼ�������ܽ�Ƚ�С��C�����
Ur-(aq)+Na+(aq)����Ȼ�������ܽ�Ƚ�С��C�����
D.����C������Ur-(aq)+Na+(aq) ![]() NaUr(s)�����ƾ�������Һ�д��������ܽ���˵�������ƾ�����ˮ����һ�����ܽ�����D�����ѡA��
NaUr(s)�����ƾ�������Һ�д��������ܽ���˵�������ƾ�����ˮ����һ�����ܽ�����D�����ѡA��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��صĹ���ԭ����ͼ��ʾ�������Ϊ���軯��K3[Fe(CN)6]�������軯��K4[Fe(CN)6]�Ļ����Һ������˵������ȷ���ǣ� ��
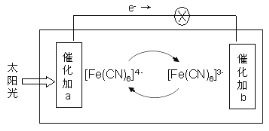
A��K+�������b
B������a���淢���Ļ�ѧ��Ӧ��[Fe(CN)6]4- - e- = [Fe(CN)6]3-
C��[Fe(CN)6]3-�ڴ���b���汻����
D���������Һ�е�[Fe(CN6)]4-��[Fe(CN6)]3-Ũ�Ȼ������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������������Һ���Ʊ�������������������������أ�װ����ͼ��ʾ������˵������ȷ���ǣ�������
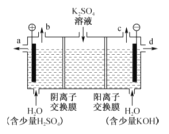
A. ͨ�翪ʼ������������ҺpH����
B. �Ƶõ�����������Һ�ӳ���d����
C. ���۵�������ӦʽΪ2H2O��4e-��4H++O2��
D. ͨ�������ӽ���Ĥ������������ͨ�������ӽ���Ĥ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�����ĩ������Cu��Cu2O��Fe2O3�е�һ�ֻ��֡�Ϊ̽������ɣ���ȡa g�ù����ĩ��Ʒ���ù�����ϡ�����ַ�Ӧ��(��֪:Cu2O+2H+��Cu2++Cu+H2O)���Ƶù�������Ϊb g���������ƶϲ���������
A. ��Ӧ����Һ�д������ڵ������������3��
B. ��Ӧ�����Һ�м���һ������NaNO3������ʹb g������ȫ�ܽ�
C. ��b��![]() a�����ɫ�����ĩһ��Ϊ������
a�����ɫ�����ĩһ��Ϊ������
D. b��ȡֵ��Χ:0��b��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������A��һ�ֽ�ǿ�Ļ�ԭ���������ô���������Һ�����İ����Ƶã�64gA��ȫȼ�յõ�4.48L�ܶ�Ϊ1.25g��L��1������B(������ܶȾ��ڱ�״���²ⶨ)��
��1��A�Ļ�ѧʽ___________________��
��2��д������������Һ�����İ����Ʊ�A�����ӷ���ʽ_________________________��A���Ʊ������а�����Ҫ������������_____________________________________��
��3��A�����ɫ��CuO��Ӧ��������B��һ��ש��ɫ�����ʣ�д���û�ѧ����ʽ__________��
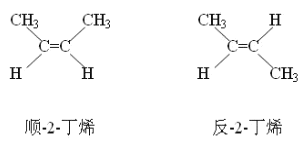
��4����֪2һ��ϩ����˳���칹(����ͼ��ʾ)������˫��ͬһ��ģ���Ϊ˳ʽ:����˫������ģ���Ϊ��ʽ�����л�����C������Ԫ����A��ͬ��Ħ������С��A��C��ͨ��A������ʵ����Ĺ�������ǡ����ȫ��Ӧ�õ���ʵ�������C���ܴ������ֽṹ����д�����ǵĽṹʽ_____________��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:N2O4(g)![]() 2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. ��ƿ��������������ٱ仯
B. ��ƿ���������ɫ���ٱ仯
C. ��ƿ�������ѹǿ���ٱ仯
D. N2O4������������NO2����������֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��е�ǰ�����ڣ��������ڵ�5��Ԫ����ͼ��ʾ����BԪ�صĺ˵����Ϊa������˵����ȷ���ǣ� ��

A. B��D��ԭ������֮�����Ϊ2
B. E��B��ԭ������֮�������8��18��32
C. 5��Ԫ�صĺ˵������֮�Ϳ���Ϊ5a��10
D. A��E��ԭ������֮�������7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��һ�����۵�̼��Դ�����ۺ����þ�����Ҫ���塣�ش��������⣺
��1��CO2���Ա�NaOH��Һ������������ҺpH=13��CO2��Ҫת��Ϊ___________��д���ӷ��ţ�����������Һc(HCO3)��c(CO32)=2��1����ҺpH=___________���������£�H2CO3��K1=4��107��K2=5��1011��
��2��CO2��CH4�����������Ƶúϳ�����CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
��֪������Ӧ����صĻ�ѧ�������������£�
��ѧ�� | C��H | C=O | H��H | C |
����/kJ��mol1 | 413 | 745 | 436 | 1075 |
��÷�Ӧ����H=______���ֱ���VL�����ܱ�����A�����ݣ���B����ѹ���ݻ��ɱ䣩�У�����CH4��CO2��1 mol�Ļ�����塣�������з�Ӧ��ƽ���ų������յ������϶����____������A�� ����B ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����ӷ���ʽ��д��ȷ���ǣ� ��
A.��NaHCO3��Һ�м���NaOH��Һ��HCO3-��OH-��CO2����H2O
B.0.1mol/LNH4Al(SO4)2��Һ��0.2mol/LBa(OH)2��Һ�������ϣ�Al3++2SO42-+2Ba2++4OH- ��2BaSO4��+AlO2-+2H2O
C.�ô����ˮ����CaCO3+2H+��Ca2++H2O+CO2��
D.������Һ�еμ���������������Һ��2H++SO42-+Ba2++2OH-��2H2O+BaSO4��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com