
【题目】模拟工业上离子交换膜法制烧碱的方法,电解硫酸钾溶液可制备氢气、氧气、硫酸和氢氧化钾,装置如图所示。下列说法不正确的是( )
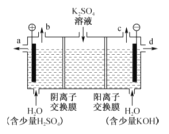
A. 通电开始后,阴极附近溶液pH增大
B. 制得的氢氧化钾溶液从出口d流出
C. 电解槽的阳极反应式为2H2O﹣4e-=4H++O2↑
D. 通过阴离子交换膜的离子数等于通过阳离子交换膜的离子数
科目:高中化学 来源: 题型:
【题目】科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
c(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
①前10分钟内的平均速率v(NO)=___________________mol·L-1·min-1
②下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内气体的密度不变时,说明反应已达平衡
D.若该反应的平衡常数K值变大,在平衡移动过程中正反应速率先增大后减小
(2)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。
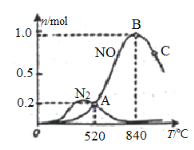
已知:反应I 4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0
4NO(g) +6H2O(g) △H<0
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g) △H<0
2N2(g) +6H2O(g) △H<0
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②反应I的活化能Ea(正)________ Ea(逆) (填“小于”“等于”或“大于”)。
③520℃时,4NH3(g)+5O2![]() 4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(3)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为________________________________________。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。
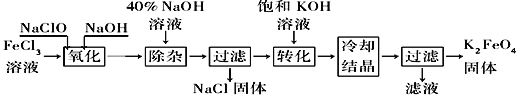
(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______![]() +______
+______![]() 。____________其中氧化剂是________(填化学式)。
。____________其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:
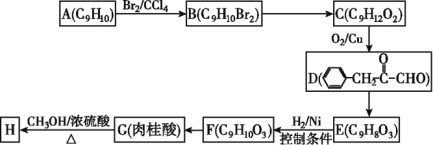
请回答下列问题:
(1)化合物A的结构简式为_____________,D中含有官能团的名称为_________________。
(2)B→C所加试剂的名称是______________,F→G的反应类型为__________。
(3)G→H的化学方程式为______________________________。
(4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________;
(4)用电子式表示MgCl2的形成过程 _____________________;
(5)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436 kJ、946 k J、391 k J。则由N2和H2反应生成1 mol NH3 需要放出_____的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
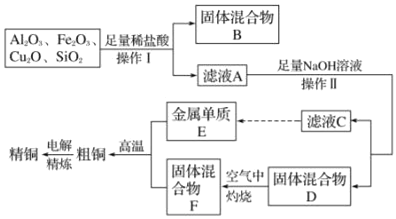
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____。它与NaOH溶液反应的离子方程式为_____。
(2)滤液A中铁元素的存在形式为_____(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____。要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为2.25mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com