
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=______。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____(填“A” 或“B ”)。
【答案】CO32- 10 +120 kJ·mol-1 B
【解析】
(1)溶液pH=13,碱性强,所以CO2主要转化为CO32-;若所得溶液c(HCO3)∶c(CO32)=2∶1,根据第二步电离常数进行计算;
(2)ΔH=Q(吸)-Q(放);正反应为气体体积增大的吸热反应,所以温度越高越有利于反应正向进行,吸热越多;
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为CO32-;若所得溶液c(HCO3)∶c(CO32)=2∶1,K2=5×1011=![]() =
=![]() ×C(H+)得出C(H+)=10-10,所以PH=10;
×C(H+)得出C(H+)=10-10,所以PH=10;
正确答案:CO32- 10。
(2)ΔH=4×413+2×745-2×1075-2×436=+120 kJ·mol-1;CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)正反应为气体体积增大的吸热反应,所以压强越小越有利于反应正向进行,吸热越多,应该选B;
2CO (g)+ 2H2(g)正反应为气体体积增大的吸热反应,所以压强越小越有利于反应正向进行,吸热越多,应该选B;
正确答案:+120 kJ·mol-1 B。


科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:
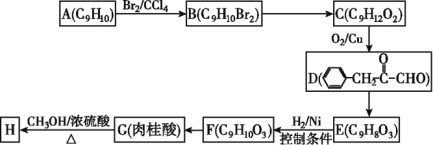
请回答下列问题:
(1)化合物A的结构简式为_____________,D中含有官能团的名称为_________________。
(2)B→C所加试剂的名称是______________,F→G的反应类型为__________。
(3)G→H的化学方程式为______________________________。
(4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
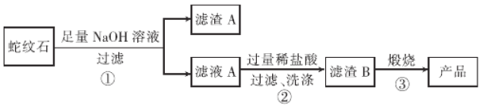
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
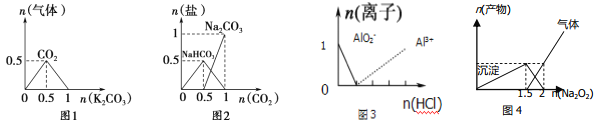
A.图1:n(HCl)=l mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(NaAlO2)=1 mol,HCl加入到NaAlO2溶液中离子的存在情况
D.图4:n(AlCl3)=1 mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A. a点时溶液中所含主要溶质为(NH4)2SO4
B. a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. b点为最大沉淀量,对应的纵坐标值为0.02
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为2.25mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
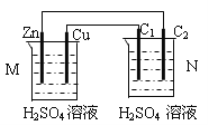
A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com