
【题目】从铝土矿中提取铝的工艺流程如下图所示,回答下列问题:
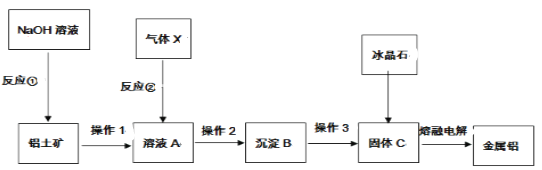
(1)气体X是___________(填化学式)。
(2)写出反应①、反应②的离子方程式:
①_________________________________;②_________________________________。
(3)操作1和操作2都是_____________,该操作要用到的玻璃仪器是:_______、____、_______。
(4)冰晶石的作用是_____________________________。
【答案】CO2 Al2O3 + 2OH == 2AlO2 + H2O AlO2 + CO2 + 2H2O == Al(OH)3↓ + HCO3- 过滤 玻璃棒 漏斗 烧杯 降低氧化铝熔融温度
【解析】
根据铝土矿中提取铝的工艺流程图知,反应①为氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,操作1为过滤操作,溶液A为偏铝酸钠溶液,向偏铝酸钠溶液通入的气体为CO2,根据得沉淀B知操作2为过滤,沉淀B为氢氧化铝,根据得到固体C推出操作3为灼烧,固体C为三氧化二铝;冰晶石又名氟铝酸钠或氟化铝钠,主要用作铝电解的助熔剂,降低氧化铝的熔融温度。
(1)根据分析得气体X是CO2,故本题答案为:CO2;
(2)根据分析得反应①氧化铝与NaOH溶液反应生成偏铝酸钠和水、反应②偏铝酸钠与二氧化碳反应生成氢氧化铝和碳酸氢钠,反应①、反应②的离子方程式:①Al2O3 + 2OH== 2AlO2 + H2O,②AlO2 + CO2 + 2H2O == Al(OH)3↓ + HCO3-,故本题答案为:①Al2O3 + 2OH == 2AlO2 + H2O,②AlO2 + CO2 + 2H2O == Al(OH)3↓ + HCO3-
(3)根据分析得操作1和操作2都是过滤,过滤操作用到的玻璃仪器有:玻璃棒、漏斗、烧杯,故本题答案为:过滤;玻璃棒;漏斗;烧杯;
(4)根据分析得冰晶石又名氟铝酸钠或氟化铝钠,主要用作铝电解的助熔剂,降低氧化铝的熔融温度,故本题答案为:降低氧化铝的熔融温度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
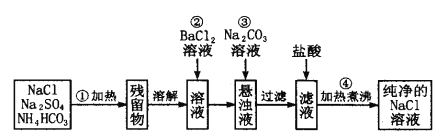
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O =4NaOH+O2↑B.Cl2+ H2O![]() HClO + HCl
HClO + HCl
C.2F2+2H2O=4HF+O2D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法不正确的是
。下列说法不正确的是
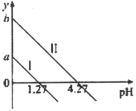
A.直线Ⅱ表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.![]() 对应1.27<pH<4.27
对应1.27<pH<4.27
D.![]() 对应pH=7
对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
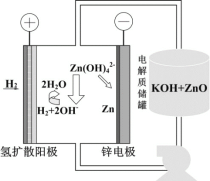
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
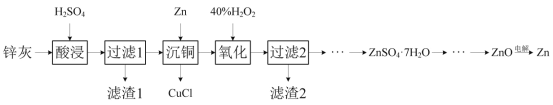
已知:①锌灰的主要成分为ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和__。
(2)酸浸时,若硫酸浓度过高,可能发生副反应的化学方程式为__。
(3)写出“沉铜”时的离子方程式__。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是__。
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S![]() ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
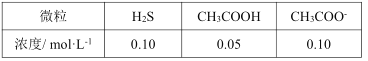
处理后的废水的pH=__,c(Zn2+)=__。
(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
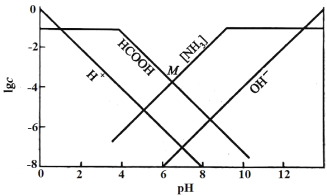
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是

A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
硫酸 化学纯(CP)
(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为________(填序号)。
(2)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制240 mL 0.1 mol·L-1的稀硫酸,需取该浓硫酸________ mL,计算所需浓硫酸的体积用到的公式___________。
(3)接下来完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、___________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是_________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为________。
(5)下列操作会使所配溶液浓度偏高的是____(填字母)。
A 转移溶液时未洗涤烧杯
B 定容时俯视容量瓶的刻度线
C 容量瓶用蒸馏水洗净后仍残留有蒸馏水
D 用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com