
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
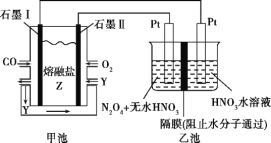
A. 石墨Ⅰ是原电池的负极,发生氧化反应
B. 甲池中的CO32-向石墨Ⅱ极移动
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3![]() 2N2O5+2H+
2N2O5+2H+
D. 若甲池消耗标准状况下的氧气2.24 L,则乙池中产生氢气0.05 mol
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】取一定质量的氧化亚铜和氧化铜混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少 6.4g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体 4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/LB. 3.2mol/LC. 2.8mol/LD. 2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。
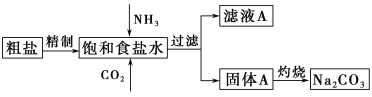
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→________→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣 b.加入盐酸调pH c.加入Ba(OH)2溶液d.加入Na2CO3溶液 e.过滤
(2)向饱和食盐水中先通入_______,后通入________
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干、称量、计算。
(3)洗涤沉淀的具体操作是_____________________________。
方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。
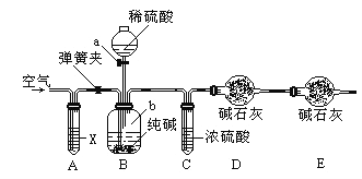
(4)装置A中试剂X应选用_________________。
(5)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式 _______,该物质与A2C反应的离子方程式______。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.则甲、乙反应的化学方程式为____________。
(4)E的最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应 B.常温下无现象 ,G单质不溶解
C.受热能发生反应,开始放出氢气 D. 受热能发生反应,开始放出是SO2
(5)用电子式写出A2C的形成过程___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构决定性质,研究物质的组成、结构对于学习物质的性质至关重要。
(1)如图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点、b点分别代表的是 ___________、___________ (写化学式),a比b的沸点高的原因是__________________________________。

(2)在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。由此推测该CO2晶体中O—C—O键角为__________,与石英相比该晶体的熔点、沸点________(“更高”或“更低”),理由是_________________________________。
(3)利用铜萃取剂M可通过如下反应实现铜离子的富集:


①M所含元素的电负性由大到小顺序为____,其中氮原子以__轨道与氧原子形成σ键。
②M与W(右图)相比,M的水溶性较小,更利于Cu2+的萃取。M水溶性较小的主要原因是___________________________________。
(4)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。
。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物 A~J在一定条件下的转化关系(部分产物及反应条件未列出)。其中C为红棕色气体;H和I是两种常见的金属单质;过量I与 D溶液反应生成A。

请填写下列空白:
(1)H元素在周期表中的位置是________;写出①的离子反应方程式:_________;检验E溶液中阳离子的最佳试剂为________。
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为__________。
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为__________。
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移____________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y 的说法不正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com