
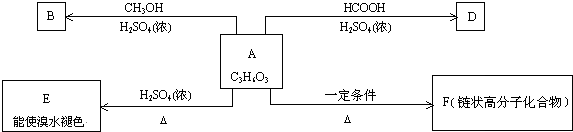
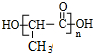 ,据此解答.
,据此解答.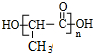 ,
,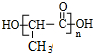 ,故答案为:CH3CH(OH)COOCH3;
,故答案为:CH3CH(OH)COOCH3;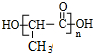 ;
;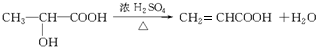 ,
,| 浓硫酸 |
| △ |
 ;
;| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-Q | ||||||
B、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-
| ||||||
C、
| ||||||
| D、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>D>B |
| B、元素B的气体氢化物的沸点比元素E气体氢化物的沸点高 |
| C、元素A的氧化物的大量排放能引起温室效应 |
| D、元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
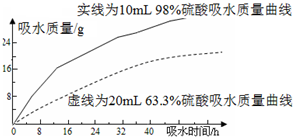 探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)
探究浓硫酸的吸水性.某同学把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,根据室温环境下实验的数据绘成的曲线如图.由如图曲线你能得到的实验结论有哪些?(写两点)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的氮原子数目为NA |
| B、1mol铁与足量氯气反应转移电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、1mol?L-1 K2SO4溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度和压强可能是标准状况 |
| B、标准状况下该纯净物若为气态,其体积是22.4L |
| C、该气体分子为双原子分子 |
| D、若在该条件下O2为气态,则此时1mol O2的体积为30L |
查看答案和解析>>
科目:高中化学 来源: 题型:
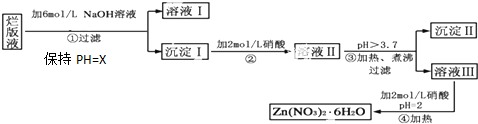
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com