
【题目】X、Y是同周期的主族元素,且电负性大小:![]() 。下列说法错误的是
。下列说法错误的是
A.X与Y形成的化合物中,X显负价,Y显正价
B.第一电离能可能Y小于X
C.X的最高价含氧酸酸性弱于Y的
D.气态氢化物的稳定性:![]() 小于
小于![]()
科目:高中化学 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。实验时按如下步骤操作:

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数。
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_______________________;装置②的作用是_________________________
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为_______________________________________________________。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是____________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是___________(写一种即可)。
(5)某人设想以右图所示装置用电化学原理生产硫酸, 写出通入SO2的电极的电极反应式___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | HSCN | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的主要的电离方程式_________________。若将碳酸饱和溶液稀释10 倍,则稀释后的溶液中 c(H+)______原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为_______(用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
(3)常温下,有浓度均为1 mol·L-1的下列4种溶液:①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液,其中由水电离的H+浓度由大到小的顺序是__________。(均填序号)
(4)常温下,几种弱电解质的pK(pK=-lg K)如下表所示:
电解质 | H3BO3 | CH3NH2 | HN3 | H2CrO4 |
pK | 9.3 | 3.4 | 4.7 | pK1=0.74,pK2=6.5 |
请回答下列问题:
①硼酸(H3BO3)在水中存在电离平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推断,硼酸是___(填字母)。
B(OH)4-+H+。由此推断,硼酸是___(填字母)。
a.一元酸 b.三元酸 c.强酸 d.弱酸
②常温下,在H3BO3、HN3、H2CrO4中酸性最强的是______________(填化学式)。
③H2CrO4的二级电离常数表达式Ka2=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物![]() 的结构简式如图
的结构简式如图![]() 的说法正确的是
的说法正确的是
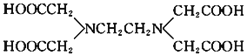
A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,但空间构型不同
互为等电子体,但空间构型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,下列说法错误的是

A. 上图所涉及到的化学反应都是氧化还原反应
B. N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C. NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D. 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是
实验目的 | 实验步骤 | |
A | 检验溶液中是否存在 | 用洁净的玻璃棒蘸取少量溶液在酒精灯上灼烧,观察火焰颜色 |
B | 检验久置的 | 取样配成溶液,加入盐酸酸化,再加 |
C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体依次通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
D | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2做反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3和浓硫酸净化气体
C.制氨气时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示:

可能用到的有关数据如下表所示:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
下列说法错误的是
A.反应物加入顺序:先加入环己醇,然后在冷却搅动下缓慢加入浓硫酸
B.粗产物用少量碳酸钠溶液洗涤,洗涤后的环己烯粗产物应该从分液漏斗下口流出
C.冷凝管中冷却水由a口进入,b口流出
D.洗涤后的环己烯粗产物需经蒸馏操作提纯,收集83℃左右的馏分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com