
(10 分)结合下列实验装置图回答问题: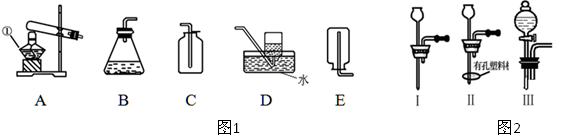
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是 ,收集装置是 。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 Na2CO3 + H2O +CO2↑
Na2CO3 + H2O +CO2↑
NH4HCO3 NH3 ↑+ H2O +CO2↑
NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是 。
他不选用碳酸氢铵制取CO2的理由是 。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
科目:高中化学 来源: 题型:阅读理解
(10 分)SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
(1)结合上图数据,判断下列说法正确的是 ▲ 。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
▲ 。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
在上述条件下反应能够自发进行,则反应的![]() ▲ 0(“>”、“<”、“=”)。在该温度下,反应的平衡常数K= ▲ 。
▲ 0(“>”、“<”、“=”)。在该温度下,反应的平衡常数K= ▲ 。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省南昌二中高一下学期期中考试化学试卷 题型:填空题
(10分)类推法是科学学习的重要方法之一
(1)下列类推结论正确的是:
| | 类比对象 | 结论 |
| A | Cl2+H2O HCl+H HCl+H ClO ClO | I2+H2O HI+HIO HI+HIO |
| B | C+2CuO  2Cu+CO2↑ 2Cu+CO2↑ | C+SiO2  Si+ CO2↑ Si+ CO2↑ |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2 反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高一10月月考化学试卷(解析版) 题型:实验题
(10 分)结合下列实验装置图回答问题:
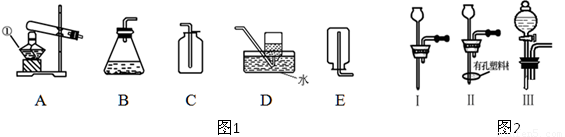
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是 ,收集装置是 。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3
 Na2CO3 + H2O
+CO2↑
Na2CO3 + H2O
+CO2↑
NH4HCO3
 NH3 ↑+ H2O +CO2↑
NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是 。
他不选用碳酸氢铵制取CO2的理由是 。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省富阳市高三上学期期中考试化学试卷 题型:实验题
(10分) 在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH == K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04 == K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203== Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用 滴定管移取步骤③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是: ;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是 ;
(3)步骤④的A溶液最合适的是 ;滴定终点的判断方法是 ;
(4)步骤④应该选用 (填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
|
序号 |
滴定前/mL |
滴定后/mL |
|
① |
1.35 |
19.40 |
|
② |
1.05 |
19.00 |
|
③ |
1.58 |
20.91 |
根据数据计算该样品中总二氧化硫的浓度为 mol/L,故该干白葡萄酒是 (填“合格”“不合格”)产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com