
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) ![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. Z的体积分数变小
C. (a+b)>(c+d) D. X的转化率变大
科目:高中化学 来源: 题型:
【题目】某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制
100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有________(选填序号),还缺少的仪器有________(写仪器名称)。
(2)配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL(保留一位小数),量取浓硫酸时应选用__________(选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是________。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
A.硫酸、纯碱、石膏
B.硫酸、烧碱、胆矾
C.硫酸氢钠、生石灰、醋酸钠
D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
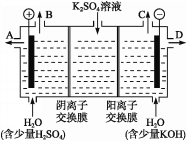
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
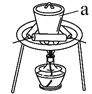
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
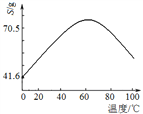
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:

(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”);
(2)25℃时,将![]() =11的NaOH溶液与
=11的NaOH溶液与![]() =4的
=4的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() =9,则NaOH溶液与
=9,则NaOH溶液与![]() 溶液的体积比为____________;
溶液的体积比为____________;
(3)95℃时,若100体积![]() 1=
1=![]() 的某强酸溶液与1体积
的某强酸溶液与1体积![]() 2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的![]() 1与强碱的
1与强碱的![]() 2之间应满足的关系是_______。
2之间应满足的关系是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是 ( )
A. CH4 + Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. 2CH3CH3+5O2![]() 2CO2+6H2O
2CO2+6H2O
C. ![]()
D. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:"用水银一两,白矾[KAl(SO4)2]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
(1)甘汞(Hg2Cl2)中化学键类型主要为___________.
(2)[KAl(SO4)2]所属物质类别为__________ (填标号)
A.酸式盐 B.复盐 C.正盐 D.混盐 E.硫酸盐
(3)文中“同研”涉及的操作,若在实验室通风橱内完成,则所需的仪器是_______。
(4)文中“则粉升于盆上矣”涉及的混合物分离方法是__________
(5)甘汞(Hg2Cl2)制备反应中,氧化剂与还原剂的物质的量之比为_________,该反应中还原产物是__________。
(6)已知文中一两等于十钱,则甘汞的产率约为________(保留三位有效数字)。
(7)由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com