
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
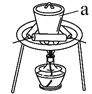
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
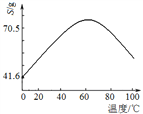
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
【答案】 水浴加热 引入H+使Fe3+不容易沉淀 4FeS2 + 11O2![]() 2Fe2O3 + 8SO2 坩埚 NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全 向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥
2Fe2O3 + 8SO2 坩埚 NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全 向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥
【解析】(1) “水浸”阶段需在70~80℃条件下进行,水的沸点为100℃,适宜的加热方式为水浴加热;(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②引入H+使Fe3+不容易沉淀;(3)“灼烧”时FeS2在空气中与氧气反应生成氧化铁和二氧化硫,发生反应的化学方程式为4FeS2 + 11O2![]() 2Fe2O3 + 8SO2;实验室用于灼烧固体的仪器是坩埚,则仪器a的名称为坩埚;(4)NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全,Fe2O3含量反而降低;(5)向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥,得到ZnSO4晶体。
2Fe2O3 + 8SO2;实验室用于灼烧固体的仪器是坩埚,则仪器a的名称为坩埚;(4)NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全,Fe2O3含量反而降低;(5)向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥,得到ZnSO4晶体。


科目:高中化学 来源: 题型:
【题目】有关化学与生产、生活相关的叙述正确的是( )
A.碘酒能消毒是利用碘的还原性
B.葡萄糖注射液不能产生丁达尔效应,不属于胶体
C.14C可用于文物的年代鉴定,14C与12C互为同素异形体
D.某溶液中加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为__________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为__________;
(3)A、C两元素可组成10电子粒子X-,Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为__________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为__________;
(5)我国首创的海洋电池以E的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为__________,电池总反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) ![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. Z的体积分数变小
C. (a+b)>(c+d) D. X的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是
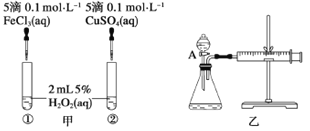
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞。将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应处于平衡状态时,下列说法正确的是
A. 各组分浓度不再随时间而变化 B. 反应物浓度等于生成物浓度
C. 反应物质量等于生成物质量 D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料转化成葡萄糖内酯并获得能量。下列说法正确的是( )

A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反成为:MnO2+2H2O+2e-=Mn2++4OH-
D. 当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)B的结构简式为______________,C中官能团的名称为__________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是___________________。
(4)丙烯酸乙酯的结构简式为_______________。
(5)写出下列反应方程式和有机反应基本类型:
③___________________________,___________反应;
⑤___________________________,___________ 反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com