
【题目】A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为__________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为__________;
(3)A、C两元素可组成10电子粒子X-,Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为__________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为__________;
(5)我国首创的海洋电池以E的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为__________,电池总反应的化学方程式为__________。
【答案】第二周期第VA族2Al+2OH-+2H2O=2AlO2-+3H2↑![]() Cu+H2SO4+H2O2=CuSO4+2H2OO2+4e-+2H2O=4OH-4Al+3O2+6H2O=4Al(OH)3
Cu+H2SO4+H2O2=CuSO4+2H2OO2+4e-+2H2O=4OH-4Al+3O2+6H2O=4Al(OH)3
【解析】
A、B、C、D、E为短周期元素,A到E原子序数依次增大。E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N,据此解答。
根据以上分析可知A、B、C、D、E分别是H、N、O、Na、Al。则
(1)B为N,原子序数为7,位于元素周期表中第二周期ⅤA族;
(2)Na与水反应生成NaOH,Al与NaOH溶液反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)A、C两元素可组成10电子粒子X-为OH-,Y与X-具有相同的原子种类及数目,且不带电,Y是羟基,电子式为![]() ;
;
(4)A2C2为H2O2,与Cu、硫酸发生氧化还原反应生成硫酸铜和水,该反应的方程式为Cu+H2SO4+H2O2=CuSO4+2H2O;
(5)原电池的负极发生失去电子的氧化反应,则铝是负极。正极发生得到电子的还原反应,空气在正极通入,氧气得到电子,正极反应式为O2+4e-+2H2O=4OH-,总反应式为4Al+3O2+6H2O=4Al(OH)3。


科目:高中化学 来源: 题型:
【题目】向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
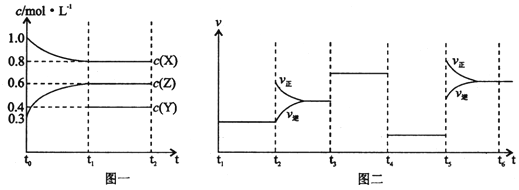
A.Y的起始物质的量为0.5 mol
B.该反应的化学方程式为:2X(g)+Y(g) ![]() 3Z(g) H<0
3Z(g) H<0
C.若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
A.硫酸、纯碱、石膏
B.硫酸、烧碱、胆矾
C.硫酸氢钠、生石灰、醋酸钠
D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两个化学反应,属于同一反应类型的一组是
A. 由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B. 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷
C. 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D. 由苯制硝基苯;由苯制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
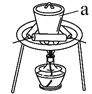
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
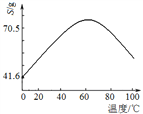
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A.都能使品红试液褪色
B.都能和氢氧化钠溶液反应生成盐和水
C.都有刺激性气味
D.常温下都是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com