
| A、X与Y形成化合物是,X可以显负价,Y显正价 |
| B、第一电离能可能Y小于X |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| D、气态氢化物的稳定性:HmY小于HmX |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 | B、22 | C、24 | D、30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
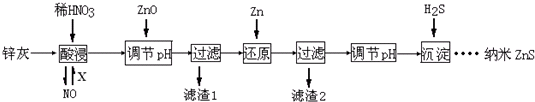
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含Na+为2mol的Na2SO4溶液 |
| B、将31g Na2O溶于水并配成1L的溶液 |
| C、将0.5mol/L的KNO3溶液100mL加热蒸发掉50g水的溶液 |
| D、将58.5gNaCl溶于1L水所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com