
����Ŀ����ѧ�Լ�Ӧ���������ʺ���̬������Ч���Ʊ��棺
(1)�����Լ�Ӧ������____________�У�Һ���Լ�������____________�У������ֽ���Լ�(�磺ŨHNO3��AgNO3��)Ӧ��____________ɫ�Լ�ƿ���档�����(HF)��Ͳ����е�SiO2ǿ�ҷ�Ӧ����ʴ������Ӧ��____________��ţ������ơ���Ӧ������____________�У���������Ӧ�ñ�����____________�С�
(2)������ˮ�豣������ɫ�Լ�ƿ�У�ԭ����__________________��
(3)ʵ���������Ƶ�����������Һ��һ��Ҫ��������___________����ֹ�ڿ����б��ʡ�
(4)��ʢ��Ũ������Լ�ƿ��ǩ��ӡ�����о�ʾ��ǣ�˵��Ũ�������_______�ԡ�

���𰸡����ƿ ϸ��ƿ �� ����ƿ ú�� ��ˮ ������ˮ�к��д����ᣬ����ֽ������ ����(����м) ��ʴ
��������
(1)�������ڹ��ƿ�У�Һ���Լ�������ϸ��ƿ�У������ֽ��������ܹⱣ�棬Ӧ����ɫ�Լ�ƿ���棻����ᣨHF����Ͳ����е�SiO2ǿ�ҷ�Ӧ�������ò���ƿ��š���������ƿ��ţ������ơ�������ˮ�������ȷ�Ӧ��Ӧ������ú���У������ڿ���������ȼ����������Ӧ�ñ�������ˮ�У�
���ǣ����ƿ��ϸ��ƿ���أ�����ƿ��ú�ͣ���ˮ��
(2) ������ˮ�к��д����ᣬ������ȶ�������ֽ⣬���豣������ɫ�Լ�ƿ�У�
���ǣ�������ˮ�к��д����ᣬ����ֽ�����ʣ�
(3)�������Ӿ���ǿ�Ļ�ԭ�ԣ��ڿ������ױ���������Ϊ�����ӣ���˿����������Ƶ�����������Һ�м������������ۣ���ֹ�������ӱ�����Ϊ�����ӣ��ڿ����б��ʣ�
���ǣ�����(����м)��
(4) ��ʾ���Ϊ��ʴ��Һ��ı�־��˵��Ũ������и�ʴ�ԣ�
�ʴ��ǣ���ʴ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ϸ�Ӧ������NH4Cl(�׳���ɰ)��һ������Ⱦ�����塣ijѧϰС����������װ��ģ��÷�Ӧ,��ش�������⡣

(1)��ʵ�����������������Ũ������MnO2��Ӧ��ȡ��װ��A������X������Ϊ____;X�з�����Ӧ�����ӷ���ʽΪ_______��
(2)Ҫ�õ����﴿��������,����A��B��Cװ�õ�����˳������Ϊa��_____(��Сд��ĸ��ʾ)��
(3)����Eװ��,������������������ֻ�Ϸ�Ӧ����Ӧ��_______(��Сд��ĸ��ʾ)ͨ��,��Ӧ�Ļ�ѧ����ʽΪ_______________;���ܹ۲쵽��������___________��
(4)���Ʊ��ݡ�������ɰ��ҩ����ɢ������,��Ȼ��ɰ������NH4Cl����ȡ��Ȼ��ɰ����NH4Cl�����ⶨ��ȷ��ȡһ��������ɰ,������������ͭ���,����ͼ��ʾ����ʵ�顣��֪:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O ��
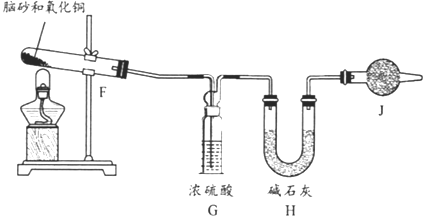
��Ϊ˳������й��������IJⶨ,���������б���:
����ʱ��� | ����ǰ | ���۲쵽_____����ʱ |
�������� | _______________ | ֹͣ����,��ȴ,����Hװ�õ������� |
���������Jװ��,���NH4Cl�ĺ�����_____(����ƫ������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mLNa2SO4��Na2CO3�Ļ����Һ�м��������BaCl2��Һ���õ�14.51g��ɫ���������ɫ�����м��������ϡHNO3����ַ�Ӧ�������ٵ�4.66g���������������
��1��ԭ�����Һ��Na2SO4��Na2CO3�����ʵ���Ũ�ȸ���______��
��2�������������ڱ�״���µ������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)�ڹ�ҵ����������Ϊ��ʵ���Һϳ�S2Cl2��ij��ѧ�о���ѧϰС��������й����ϣ��õ�������Ϣ��
�ٽ������������110�桫140������Ӧ�����ɵ�S2Cl2��Ʒ��
���й����ʵIJ����������±���
���� | �۵�/�� | �е�/�� | ��ѧ���� |
S | 112.8 | 444.6 | �� |
S2Cl2 | ��77 | 137 | ��ˮ����HCl��SO2��S���������������S2Cl2��Cl2 �¶ȳ�300��������ȫ�ֽ�Ϊ������� |
���ʵ��װ��ͼ���£�

(1)��ͼ�����巢����β������װ�ò������ƣ���������Ľ����_______________________��
���øĽ������ȷװ�ý���ʵ�飬��ش��������⣺
(2)B�з�Ӧ�����ӷ���ʽΪ_________________________________________________________��
(3)C��D�е��Լ��ֱ���_________________��_____________________��
(4)����A��B�����Ʒֱ���___________��___________��F��������_______________________��
(5)����ڼ���Eʱ�¶ȹ��ߣ���ʵ������Ӱ��_________________________________����F�п��ܳ��ֵ�������________________________________________________��
(6)S2Cl2��Ʒ�п��ܻ��е�������(��д�������ʵĻ�ѧʽ)______________��_____________��Ϊ�����S2Cl2�Ĵ��ȣ��ؼ��IJ����ǿ��ƺ��¶Ⱥ�_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʴ�̼ӹ������У��������������������������ϴ���������ϴ��ˮ�� pH��1.5���ҵ�ij��ϴ��ˮ�к���Ԫ����������Լ3%����������Ԫ����ͭ������п�� ��Ũ�Ƚϵͣ���ҵ���ۺ�������ϴ��ˮ���Ʊ����Ȼ������Ʊ��������£�

��ؽ������������������������pH���±���ʾ��

�ش��������⣺
��1�����к���ʱ������Ӧ�Ļ�ѧ����ʽΪ__________________������pH��________��Χ�������ں����Ʊ��ô��ȽϸߵIJ�Ʒ��
��2�����ܴ����кͺ��������ʹ��Ԫ�ؽ�����������ҵ���ᷴӦʱ����ͬ��Ӧ�¶��� ����������ʱ��仯��ͼ(a)��ʾ����֪���ܵ�����¶�Ϊ_______________�����ղ�ͬ�Ĺ�Һ�ȣ�������ҵ�����Ͷ������ȣ����з�Ӧʱ������������ʱ��仯�� ͼ(b)��ʾ��ʵ�������й�Һ��ѡ��1.5:1��ԭ����___________��

��3������ʱ����ѡ�����ƻ��������Ϊ����������100L��������������Һ��Fe 2������Ϊ1.2molL1������Ͷ����������������������Ϊ_____________��
��4������ʱ����������������⣬Ҳ�ɲ��ö��Ե缫���ķ�������ʱ�����ĵ缫��ӦʽΪ____������ܷ�Ӧ�����ӷ���ʽ�� ___��
��5�����õ���FeCl3��Һ��HCl������_________�����ˡ�ϴ�ӡ������FeCl36H2O���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�����H2ȡ��CH4��CH4��O2���ó�CO2��H2����Ӧ�٣���Ȼ��CH4��O2��Ӧ��������CO2��H2O����Ӧ�ڣ�������ˮ����ʱ��H2O��CH4��Ӧ����Ӧ�ۣ����±� Ϊ������Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��K��

��1����Ӧ�ٵ�ƽ�ⳣ��K�ٵı���ʽΪ_______________��
��2����Ӧ�٢ڢ۵�ƽ�ⳣ��K�١�K�ڡ�K��֮��Ĺ�ϵΪK��=_____________���ú�K�١� K�۵�ʽ�ӱ�ʾ������Ӧ�٢ڢ۵ķ�Ӧ�ʱ䣺��H�١���H�ڡ���H��֮��Ĺ�ϵΪ��H��= _____________���ú���H�ڡ���H�۵�ʽ�ӱ�ʾ����
��3�����������£���Ӧ�۵������뷴Ӧ���̹�ϵӦ��Ӧ��ͼ�е�_____________����Ӧ�� �������뷴Ӧ���̹�ϵӦ��Ӧ��ͼ�е�_____________��

��4��Ϊʹ��Ӧ�����ܰ�����H2�ķ�����У���ֻ���Ƿ�Ӧ�ۣ��Ҳ����ͷ�Ӧ���ʣ��ɲ� ȡ__________��ʩ����ֻ���Ƿ�Ӧ�٢ڣ�����ȡ���´�ʩ�⣬���ɲ�ȡ_____________��д��������ʩ���ɣ���
��5��250��ʱ�������Ͻ�Ϊ����������CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)����40L ���ܱ�������ͨ��6molCO2(g)��6molCH4(g)��ƽ��ʱ�����ϵ��CH4��������� Ϊ10%������������ܶ�Ϊ______g/L��CO2��ת����Ϊ__________��������λ��Ч���֣���
2CO(g)+2H2(g)����40L ���ܱ�������ͨ��6molCO2(g)��6molCH4(g)��ƽ��ʱ�����ϵ��CH4��������� Ϊ10%������������ܶ�Ϊ______g/L��CO2��ת����Ϊ__________��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A.�����մɵ���Ҫԭ����ʯ��ʯ�����
B.��ͨ��������Ҫ�ɷ�ֻ���ж�������
C.���������������������
D.̼�����ֽ�ʯӢɰ��������ɰ�ֺ�ɰֽ��ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ܶ�Ϊ![]() ��HCl����������Ϊ
��HCl����������Ϊ![]() ���Լ��㣺
���Լ��㣺
��1������������ʵ���Ũ���Ƕ��٣���С���������λ��_________
��2���������ĸ�������Һ�У�����þ�ۺ����ۻ����![]() ����ַ�Ӧ������
����ַ�Ӧ������![]() ���壨��״��������������þ������������Ϊ���٣�____________��_______________
���壨��״��������������þ������������Ϊ���٣�____________��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ���رջ��������������ң������ͬ��������һ����H2��Cl2����ǡ��ʹ�������������ܶ���ͬ����������ȼʹH2��Cl2��ַ�Ӧ�����Ȼ�������:H2+Cl2=2HCl���ָ���ԭ�¶Ⱥ������ж���ȷ����
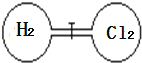
A. ��ʼʱ�������ҷ�������ͬ
B. ������������H2����
C. ��Ӧǰ��H2��ѹǿ��ͬ
D. �����������ܶ���ԭ����ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com