
����Ŀ������ʴ�̼ӹ������У��������������������������ϴ���������ϴ��ˮ�� pH��1.5���ҵ�ij��ϴ��ˮ�к���Ԫ����������Լ3%����������Ԫ����ͭ������п�� ��Ũ�Ƚϵͣ���ҵ���ۺ�������ϴ��ˮ���Ʊ����Ȼ������Ʊ��������£�

��ؽ������������������������pH���±���ʾ��

�ش��������⣺
��1�����к���ʱ������Ӧ�Ļ�ѧ����ʽΪ__________________������pH��________��Χ�������ں����Ʊ��ô��ȽϸߵIJ�Ʒ��
��2�����ܴ����кͺ��������ʹ��Ԫ�ؽ�����������ҵ���ᷴӦʱ����ͬ��Ӧ�¶��� ����������ʱ��仯��ͼ(a)��ʾ����֪���ܵ�����¶�Ϊ_______________�����ղ�ͬ�Ĺ�Һ�ȣ�������ҵ�����Ͷ������ȣ����з�Ӧʱ������������ʱ��仯�� ͼ(b)��ʾ��ʵ�������й�Һ��ѡ��1.5:1��ԭ����___________��

��3������ʱ����ѡ�����ƻ��������Ϊ����������100L��������������Һ��Fe 2������Ϊ1.2molL1������Ͷ����������������������Ϊ_____________��
��4������ʱ����������������⣬Ҳ�ɲ��ö��Ե缫���ķ�������ʱ�����ĵ缫��ӦʽΪ____������ܷ�Ӧ�����ӷ���ʽ�� ___��
��5�����õ���FeCl3��Һ��HCl������_________�����ˡ�ϴ�ӡ������FeCl36H2O���塣
���𰸡�Ca(OH)2��2HCl=CaCl2��2H2O��3Ca(OH)2��2FeCl3=2Fe(OH)3��3CaCl2 3.7<pH<4.2 65�� ��Һ�ȴ�ʱ�����Ľ����ʵͣ���Һ��С��Ȼ�����ʸߣ�����ϡ��FeCl3��Һ����Ũ�������Ĺ��������������˳ɱ��� 2040g 2H����2e��=H2�� Fe2����2H��![]() H2����2Fe3�� ����Ũ������ȴ�ᾧ
H2����2Fe3�� ����Ũ������ȴ�ᾧ
��������
��1���������ȥ������������������ǹ����ģ���˼�����ʯ�ҷ�����ӦCa(OH)2��2HCl=CaCl2��2H2O����ˮ�к���Ԫ����������Ϊ3%���������������ϵͣ���˻�����3Ca(OH)2��2FeCl3=2Fe(OH)3��3CaCl2����������ͼ���кͺ���ˣ������������ܣ��Լ��õ���Ʒ������pH��FeԪ��ȫ��ת���ɳ������������Ԫ�ز�������Һ�У���˷�Χ��3.7<pH<4.2��
��2������ͼ(a)����Ӧ�¶�Ϊ65��ʱ������������ߣ�������ܵ�����¶�Ϊ65�棻����ͼ��(b)��֪����Һ�ȴ�ʱ�����Ľ����ʵͣ���Һ��Сʱ��Ȼ�����ʸߣ�����ϡ��FeCl3��Һ����Ũ�������Ĺ��������������˳ɱ������ʵ�������й�Һ��ѡ��1.5��1��
��3��Fe2������ԭ����H2O2�������������ݵ�ʧ������Ŀ�غ㣬n(H2O2)=n(Fe2��)/2=100L��1.2mol��L��1/2=60mol����m(H2O2)=60mol��34g��mol��1=2040g��
��4��������Fe2����Fe3�������ݵ��ԭ����Fe2��Ӧ�������Ϸŵ磬�����缫��ӦʽΪ2H����2e��=H2����������ӦʽΪFe2����e��=Fe3��������ܵ缫��ӦʽΪ2Fe2����2H��![]() H2����2Fe3����
H2����2Fe3����
��5��FeCl3��Һ��ˮ�⣬��˵õ�FeCl3��6H2O����FeCl3��Һ��HCl����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���в���ȷ���ǣ� ��
A.2.4g����þ���þ����ʱʧȥ�ĵ�����Ϊ0.2NA
B.��״���£�11.2 L CCl4����������Ϊ0.5NA
C.���³�ѹ�£�28g N2������ԭ�Ӹ���Ϊ2NA
D.16g O2��O3�Ļ�������к���ԭ����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��ҽҩ��Ⱦ�ϡ����ϵ���ҵ�ж����Ź㷺��Ӧ�á�ʵ����ͨ����ͼ��ʾ�������ɼױ������Ʊ�����ȩ���Իش��������⡣

(1)Mn2O3�����ױ��ķ�Ӧ��Ҫ���Ͻ��裬�����������_______��
(2)�ױ���������õ��Ļ����ͨ���ᾧ�����˽��з��룬�ù������轫�������ȴ����Ŀ����_______��
(3)ʵ������У���ѭ��ʹ�õ�������_______��_______��
(4)ʵ���з���ױ��ͱ���ȩ���õIJ�������______����ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������KAl(SO4)2��12H2O]����ֽ�ȷ���Ӧ�ù㷺��ʵ�����в��÷������ޣ�����Al������Fe��Mg���ʣ��Ʊ�������������ͼ��ʾ��

���������������
A. ���մ����������������ڱ�����������Դ������
B. ��������ΪAl2(CO3)3
C. ������a���а�������Ũ������ȴ�ᾧ
D. ���������п��ù���CO2����NH4HCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϲ�����2019��Ϊ�����ʻ�ѧԪ�����ڱ��ꡱ��Ԫ��W��X��Y��Z�����ڱ��е����λ����ͼ��ʾ������Ԫ��Zλ�ڵ������ڣ�W��X��Yԭ�ӵ�����������֮��Ϊ 18������˵����ȷ����

A. ���⻯��е㣺Y>WB. ԭ�Ӱ뾶��Z>Y>X
C. �������ˮ��������ԣ�W<XD. �Ʋ�Z�ǰ뵼����ϣ�Z��Y���γɻ�����ZY4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Լ�Ӧ���������ʺ���̬������Ч���Ʊ��棺
(1)�����Լ�Ӧ������____________�У�Һ���Լ�������____________�У������ֽ���Լ�(�磺ŨHNO3��AgNO3��)Ӧ��____________ɫ�Լ�ƿ���档�����(HF)��Ͳ����е�SiO2ǿ�ҷ�Ӧ����ʴ������Ӧ��____________��ţ������ơ���Ӧ������____________�У���������Ӧ�ñ�����____________�С�
(2)������ˮ�豣������ɫ�Լ�ƿ�У�ԭ����__________________��
(3)ʵ���������Ƶ�����������Һ��һ��Ҫ��������___________����ֹ�ڿ����б��ʡ�
(4)��ʢ��Ũ������Լ�ƿ��ǩ��ӡ�����о�ʾ��ǣ�˵��Ũ�������_______�ԡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D���ַ�������ԭ�ӵ���Ŀ����Ϊ1��3��6��2���Ҷ�����18�����ӣ�B��C��������Ԫ�ص�ԭ����ɣ��ҷ���������ԭ�ӵĸ����Ⱦ�Ϊ1��2��D���ʵ��⻯���ܿ�ʴ������
��1��A�ķ���ʽ��________��д��Aԭ�ӵļ۲�����Ų�ʽ________��
��2��B���ӵ�����ԭ�ӵ��ӻ�������________�����ӿռ乹����________���÷�������________����(����ԡ��Ǽ��ԡ�)��
��3��C�Ļ�ѧʽ��________�������к��еĻ�ѧ��������________��
��4��D���ʵ��⻯��ķе��HCl�ķе�ߣ�����Ҫԭ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=2��A��B��������Һ��1 mL���ֱ��ˮϡ�͵�1 000 mL����pH����Һ���V�Ĺ�ϵ��ͼ��ʾ��

����˵����ȷ������ ��
A. A��B������Һ�����ʵ���Ũ��һ�����
B. ϡ�ͺ�A����Һ�����Ա�B����Һǿ
C. a=5ʱ��A��ǿ�ᣬB������
D. ��A��B�������ᣬ��5��a��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������ϸ������Ʒ����Ҫ�м��壬���Ʊ��漰�ķ�Ӧ���£�
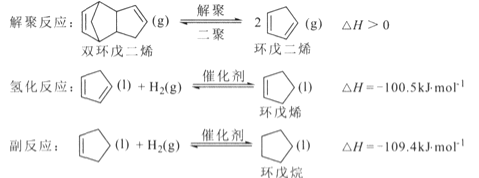
�ش��������⣺
(l)��Ӧ![]() �ġ�H= _________ kJ/mol ��
�ġ�H= _________ kJ/mol ��
(2)��۷�Ӧ�ڸ��������н��С�
�������������䣬���������˫�����ϩƽ��ת���ʵ������� ____ �����ţ�.
A.�����¶� B�������¶� C������ѹǿ D����Сѹǿ
��ʵ�������г�ͨ��ˮ�����Խ���˫�����ϩ�ķе㡣ij�¶��£�ͨ����ѹΪl00kPa��˫�����ϩ��ˮ�������ﵽƽ�����ѹΪ160kPa��˫�����ϩ��ת����Ϊ8 0%���� pH2O=___kpa��ƽ�ⳣ��Kp=______kPa (KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��)
(3) һ�������£��������ϩ�����л��ܼ��н����⻯��Ӧ����Ӧ�����б�������ѹ�����䣬��û���ϩ�ͻ�����IJ��ʣ��Ի����ϩΪԭ�ϼƣ���ʱ��仯����ͼ��ʾ��

�ٽ������ϩ�����л��ܼ��пɼ��ٶ��۷�Ӧ�ķ�����ԭ����____��
����ѵķ�Ӧʱ��Ϊ__h����ܽϴ����__����⻯��Ӧ������Ӧ������
(4)��֪�⻯��Ӧƽ�ⳣ��Ϊ1.6 �� 1012������Ӧ��ƽ�ⳣ��Ϊ2.0��10l2���ں��º����£������ϩ�����������ʵ���֮��Ϊ1��1���з�Ӧ�������ϩ�ĺ�����ʱ��仯������____�������ǻ����ϩ�Ķ��۷�Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com