
【题目】明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:

下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A.1L 1mol·L-1的NaOH溶液中含有NA个氧原子
B.常温常压下,14gCO和N2混合气所含质子总数为7NA
C.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
D.标准状况下,11.2L氦气所含的原子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤的气化、煤的液化都是物理变化
B.石油是由多种烃组成的混合物
C.汽油都不能使溴水褪色
D.乙烷的产量可以衡量一个国家石油化工的发展水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是______。
(2)产生的气体在标准状况下的体积是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
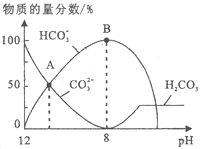
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;与过量氯气发生S2Cl2+Cl2 温度超300℃以上完全分解为硫和氯气 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式为_________________________________________________________。
(3)C、D中的试剂分别是_________________、_____________________。
(4)仪器A、B的名称分别是___________、___________,F的作用是_______________________。
(5)如果在加热E时温度过高,对实验结果的影响_________________________________;在F中可能出现的现象是________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种物质的化学式)______________、_____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:

相关金属离子生成氢氧化物沉淀的pH如下表所示:

回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如 图(b)所示,实际生产中固液比选择1.5:1的原因是___________。

(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为_____________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为____,电解总反应的离子方程式是 ___。
(5)将得到的FeCl3溶液在HCl气氛中_________、过滤、洗涤、干燥得FeCl36H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.生产陶瓷的主要原料是石灰石和黏土
B.普通玻璃的主要成分只含有二氧化硅
C.二氧化硅可用来生产光纤
D.碳化硅又叫石英砂,可用作砂轮和砂纸的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)t℃时,Kw=___,最初混合酸中c(SO42-)=___,c(Cl-)=____。
(2)A点pH=_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com