
【题目】在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)t℃时,Kw=___,最初混合酸中c(SO42-)=___,c(Cl-)=____。
(2)A点pH=_____。

【答案】10-12 0.05mol/L 0.2mol/L 1
【解析】
(1)a+b=12,该温度下,Kw=10-a×10-b=10-(a+b)=10-12,据此计算pH=11的Ba(OH)2溶液中c(OH-)和c(Ba2+),根据图像,加入20mL Ba(OH)2溶液时,沉淀量达最大,钡离子与硫酸根离子恰好反应,根据n=cV计算该阶段消耗的n(Ba2+),由离子守恒可知n(SO42-) = n(Ba2+);加入60mL Ba(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,据此计算混合溶液中n(H+),溶液中n(HCl)=n(H+)-2n(H2SO4),再根据c=![]() 计算;
计算;
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,溶液中的HCl没有反应,计算此时溶液中H+浓度,根据pH=-lgc(H+)计算。
(1)a+b=12,该温度下,Kw=10-a×10-b=10-(a+b)=10-12,pH=11的Ba(OH)2溶液中c(OH-)=![]() mol/L=0.1mol/L,c(Ba2+)=
mol/L=0.1mol/L,c(Ba2+)=![]() c(OH-)=0.05mol/L,加入20mL Ba(OH)2溶液时,沉淀量达最大,此时,钡离子与硫酸根离子恰好反应,该阶段消耗的n(Ba2+)=0.02L×0.05mol/L=0.001mol,由离子守恒可知n(SO42-) =n(BaSO4)= n(Ba2+)=0.001mol,故原溶液中c(SO42-)=
c(OH-)=0.05mol/L,加入20mL Ba(OH)2溶液时,沉淀量达最大,此时,钡离子与硫酸根离子恰好反应,该阶段消耗的n(Ba2+)=0.02L×0.05mol/L=0.001mol,由离子守恒可知n(SO42-) =n(BaSO4)= n(Ba2+)=0.001mol,故原溶液中c(SO42-)=![]() =0.05mol/L;加入60mL Ba(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,故混合溶液中n(H+)=n(OH-)=0.06L×0.1mol/L=0.006mol,溶液中n(HCl)=0.006mol-2×0.001mol=0.004mol,故原混合溶液中c(Cl-)=c(HCl)=
=0.05mol/L;加入60mL Ba(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,故混合溶液中n(H+)=n(OH-)=0.06L×0.1mol/L=0.006mol,溶液中n(HCl)=0.006mol-2×0.001mol=0.004mol,故原混合溶液中c(Cl-)=c(HCl)=![]() =0.2mol/L,故答案为:10-12;0.05mol/L;0.2mol/L;
=0.2mol/L,故答案为:10-12;0.05mol/L;0.2mol/L;
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,溶液中的HCl没有反应,溶液总体积为40mL,此时溶液中H+浓度为![]() =0.1mol/L,故pH=-lg0.1=1,故答案为:1。
=0.1mol/L,故pH=-lg0.1=1,故答案为:1。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:

下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是
A.  用图A所示配制一定浓度的稀硫酸
用图A所示配制一定浓度的稀硫酸
B.  用图B装置,实验室制备Fe(OH)2
用图B装置,实验室制备Fe(OH)2
C.  用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D.  用图D加热熔融NaOH固体
用图D加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-==4H2O、O2+2H2O+4e-==4OH-,下列说法错误的是
A. 氢气通入正极,氧气通入负极
B. 燃料电池的能量转化率不能达到100%
C. 供电时的总反应为:2H2+O2="===" 2H2O
D. 产物为无污染的水,属于环境友好电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
B. 反应过程中,若增大压强能提高SiCl4的转化率
C. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
D. 反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
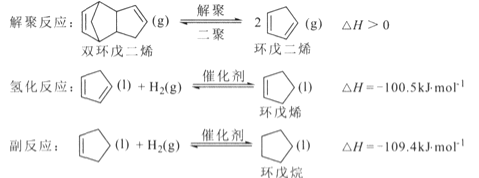
回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。

下列说法正确的是
A. 若反应①、②的平衡常数分别为K1、K2,则K1<K2
B. 实验②平衡时Y的转化率为60%
C. 减小反应③的压强,可以使平衡时c(X)=0.060 mol·L-1
D. 反应X(g)+2Y(g) ![]() Z(g)的ΔH>0
Z(g)的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
②在25 ℃条件下将pH=12的氨水稀释100倍后溶液的pH为________(填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25 ℃时,向0.1 mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________和________两种粒子的物质的量之和等于0.2 mol。
②________和________两种粒子的物质的量之和比OH-多0.1 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com