
【题目】图中所示的装置图能够达到实验目的是
A.  用图A所示配制一定浓度的稀硫酸
用图A所示配制一定浓度的稀硫酸
B.  用图B装置,实验室制备Fe(OH)2
用图B装置,实验室制备Fe(OH)2
C.  用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D.  用图D加热熔融NaOH固体
用图D加热熔融NaOH固体
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是______。
(2)产生的气体在标准状况下的体积是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.生产陶瓷的主要原料是石灰石和黏土
B.普通玻璃的主要成分只含有二氧化硅
C.二氧化硅可用来生产光纤
D.碳化硅又叫石英砂,可用作砂轮和砂纸的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐酸的密度为![]() ,HCl的质量分数为
,HCl的质量分数为![]() ,试计算:
,试计算:
(1)该盐酸的物质的量浓度是多少?(小数点后保留两位)_________
(2)在足量的该盐酸溶液中,加入镁粉和铝粉混合物![]() ,充分反应共生成
,充分反应共生成![]() 气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池(原电池)工作时,总反应为Pb +PbO2+2H2SO4→2PbSO4 +2H2O 由此可以判断:
A.原电池的电极材料:①正极为____,②负极为___。
B.工作后,蓄电池里电解质溶液的pH___(填“变大”“变小”或“不变”),理由是____。
(2)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

a.若试管内液面上升,则原溶液是___性,发生_____腐蚀,电极反应,正极为_____。
b.若试管内液面下降,则原溶液呈____性,发生____腐蚀,电极反应:负极为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH一,下列说法正确的是

A. Li极有机电解质可以换成Cu极的水溶液电解质
B. 放电时,正极的电极反应式为:Cu2O+2H++2e-=2Cu+H2O
C. 放电时,Cu极的水溶液电解质的PH值减小
D. 通空气时,整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)t℃时,Kw=___,最初混合酸中c(SO42-)=___,c(Cl-)=____。
(2)A点pH=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是
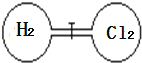
A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)具有硬度大、熔点高、耐酸碱腐蚀的优点,被广泛用于航空航天、医疗卫生及日常生活中。以钛铁矿(主要成分为FeTiO3)为主要原料冶炼金属钛的生产工艺如图所示。

回答下列有关问题:
(1)钛铁矿(精矿)中加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后Fe的化合价不变,则FeTiO3中Ti的化合价为____。
(2)上述流程图中加入“铁屑”的目的是___(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应
C.防止Fe2+水解 D.防止Fe3+水解
(3)溶液Ⅰ经“操作a”可得固体副产品甲,则操作a的名称为_______,副产品甲的化学式是_____。
(4)已知钛酸难溶于水,其化学式为H2TiO3。则溶液Ⅱ中加入水,加热时发生的化学方程式为_____。
(5)“操作b”为加热,则中间产品乙的化学式为______。
(6)一定条件下,利用气体丙与氢气可合成甲醇,该合成反应的化学方程式为____________,甲醇的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com