
【题目】(1)铅蓄电池(原电池)工作时,总反应为Pb +PbO2+2H2SO4→2PbSO4 +2H2O 由此可以判断:
A.原电池的电极材料:①正极为____,②负极为___。
B.工作后,蓄电池里电解质溶液的pH___(填“变大”“变小”或“不变”),理由是____。
(2)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

a.若试管内液面上升,则原溶液是___性,发生_____腐蚀,电极反应,正极为_____。
b.若试管内液面下降,则原溶液呈____性,发生____腐蚀,电极反应:负极为____。
【答案】PbO2 Pb 变大 H2SO4被消耗,酸性减弱 弱酸性或中 吸氧 O2+4e-+2H2O=4OH- 较强的酸 析氢 Fe - 2e-=Fe2+
【解析】
(1)根据Pb +PbO2+2H2SO4→2PbSO4 +2H2O,结合元素化合价变化分析解答;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,在酸性条件下,铁发生析氢腐蚀,据此分析解答。
(1)A.电池反应Pb +PbO2+2H2SO4→2PbSO4 +2H2O中Pb元素化合价由0价、+4价变为+2价,根据元素化合价变化知,PbO2得电子发生还原反应作正极,Pb失电子发生氧化反应作负极,故答案为:PbO2;Pb;
B.根据电池反应Pb +PbO2+2H2SO4→2PbSO4 +2H2O知,放电过程中硫酸参加反应,所以随着反应的进行,氢离子浓度减小,所以溶液的pH变大,故答案为:变大;H2SO4被消耗,酸性减弱;
(2)a.若试管内液面上升,说明试管中氧气被消耗,则钢铁发生吸氧腐蚀,溶液呈中性或弱酸性,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:弱酸性或中性;吸氧;O2+2H2O+4e-=4OH-;
b.若试管内液面下降,说明有气体生成,则钢铁发生析氢腐蚀,溶液呈酸性,负极上铁失电子发生亚铁离子,电极反应式为Fe-2e-=Fe2+,故答案为:酸;析氢;Fe-2e-=Fe2+。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛,试回答下列问题。

(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是_______。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是_______。
(3)实验过程中,可循环使用的物质有_______、_______。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是______,其原理是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质的氢化物能刻蚀玻璃。
(1)A的分子式是________,写出A原子的价层电子排布式________。
(2)B分子的中心原子的杂化类型是________,分子空间构型是________,该分子属于________分子(填“极性”或“非极性”)。
(3)C的化学式是________,分子中含有的化学键类型是________。
(4)D物质的氢化物的沸点比HCl的沸点高,其主要原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是
A.  用图A所示配制一定浓度的稀硫酸
用图A所示配制一定浓度的稀硫酸
B.  用图B装置,实验室制备Fe(OH)2
用图B装置,实验室制备Fe(OH)2
C.  用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D.  用图D加热熔融NaOH固体
用图D加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-==4H2O、O2+2H2O+4e-==4OH-,下列说法错误的是
A. 氢气通入正极,氧气通入负极
B. 燃料电池的能量转化率不能达到100%
C. 供电时的总反应为:2H2+O2="===" 2H2O
D. 产物为无污染的水,属于环境友好电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
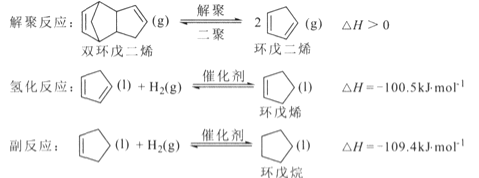
回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A.将“地沟油”进行分馏可得到汽油或柴油B.蛋白质不能发生氧化反应
C.淀粉和纤维素不互为同分异构体D.利用苯与溴水在铁粉作用下可制得溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com