
【题目】已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质的氢化物能刻蚀玻璃。
(1)A的分子式是________,写出A原子的价层电子排布式________。
(2)B分子的中心原子的杂化类型是________,分子空间构型是________,该分子属于________分子(填“极性”或“非极性”)。
(3)C的化学式是________,分子中含有的化学键类型是________。
(4)D物质的氢化物的沸点比HCl的沸点高,其主要原因是___________________。
【答案】Ar 3s23p6 sp3 V型 极性 N2H4 极性键、非极性键 HF分子之间能形成氢键
【解析】
A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,故A为Ar;B、C分子中两种原子的个数比均为1:2,故B为H2S;C分子所含原子数目为6,且分子中两种原子的个数比为1:2,故C为N2H4;D元素的氢化物能刻蚀玻璃,则D为F2,据此解答。
(1)由上述分析,可知A为Ar,处于第三周期零族,最外层电子数为8,其价层电子排布式为3s23p6,
故答案为:Ar;3s23p6。
(2)B为H2S,S原子价层电子对数=2+![]() =4,含有2对孤对电子,故S采取sp3杂化,H2S分子为V型结构,分子不是对称结构,正负电荷中心不重合,属于极性分子,
=4,含有2对孤对电子,故S采取sp3杂化,H2S分子为V型结构,分子不是对称结构,正负电荷中心不重合,属于极性分子,
故答案为:sp3;V型;极性。
(3)由上述分析可知,C为N2H4,分子中N原子之间形成非极性键、N原子与H原子之间形成极性键,
故答案为:N2H4;非极性键、极性键。
(4)HF分子之间能形成氢键,HCl分子间不存在氢键,故HF的沸点高于HCl,
故答案为:HF分子之间能形成氢键。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
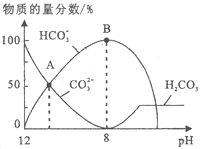
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:

相关金属离子生成氢氧化物沉淀的pH如下表所示:

回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如 图(b)所示,实际生产中固液比选择1.5:1的原因是___________。

(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为_____________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为____,电解总反应的离子方程式是 ___。
(5)将得到的FeCl3溶液在HCl气氛中_________、过滤、洗涤、干燥得FeCl36H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A,B,C,D,E,它们的阳离子可能是Na+、NH4+,Cu2+,Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO![]() 、SO
、SO![]() 、CO
、CO![]() 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B,C,E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A,C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B,C,E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含的阴离子相同的两种盐的化学式是________。
(2)D的化学式为________,D溶液显碱性的原因是(用离子方程式表示)__________________。
(3)A和C的溶液反应的离子方程式是______________。
E和氨水反应的离子方程式是___________________。
(4)若要检验B中所含的阳离子,正确的实验方法是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.生产陶瓷的主要原料是石灰石和黏土
B.普通玻璃的主要成分只含有二氧化硅
C.二氧化硅可用来生产光纤
D.碳化硅又叫石英砂,可用作砂轮和砂纸的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配置1mol/L的氢氧化钠溶液250mL。完成下列各题。
(1)应选择规格为___mL的容量瓶。该容量瓶上除注明规格外,还标有___(选填编号)
a.温度 b.浓度 c.压强 d.刻度线
(2)用电子天平秤取___gNaOH。
(3)将称好的氢氧化钠固体加适量蒸馏水将其溶解,待___后将溶液移入容量瓶中。
(4)用少量蒸馏水冲洗____2~3次,将洗液移入容量瓶中。
(5)向容量瓶内加水至接近刻度1~2cm处,改用_____小心地加入至溶液凹液面与刻度线相切。
(6)最后塞好瓶塞,摇匀,将配好的溶液移入___中并贴好标签。
(7)分析下列操作可能会对氢氧化钠溶液浓度造成的影响(填“偏高”、“偏低”或“无影响”)
①转移时容量瓶中有残留的蒸馏水___②定容时俯视___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池(原电池)工作时,总反应为Pb +PbO2+2H2SO4→2PbSO4 +2H2O 由此可以判断:
A.原电池的电极材料:①正极为____,②负极为___。
B.工作后,蓄电池里电解质溶液的pH___(填“变大”“变小”或“不变”),理由是____。
(2)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

a.若试管内液面上升,则原溶液是___性,发生_____腐蚀,电极反应,正极为_____。
b.若试管内液面下降,则原溶液呈____性,发生____腐蚀,电极反应:负极为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com