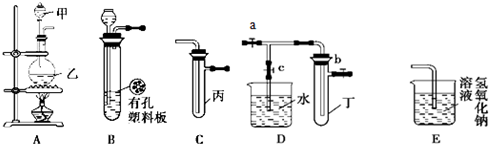
��������1��Bװ��Ϊ��״������ˮ�Ĺ����Һ�巴Ӧ��������ȡ�����װ�ã�
��2��ʵ�����Ƶõ�����������������ˮ�������Ȼ������壬�����ܺ�̼�����Ʒ�Ӧ����������̼���壻
��3����֤Cl
-��Br
-�Ļ�ԭ��ǿ���ɸ��ݷ�ӦCl
2+2Br
-=2Cl
-+Br
2���ʵ�飻
��4��Ũ�������ǿ�����ԣ���ͭ��Ӧ���ɶ����������壻
��5��NO
2��ˮ��Ӧ������ɫ����NO��
��6�����жϹ���������ijɷ֣���Ϊ������Ȼ����� 4NO
2+O
2+2H
2O=4HNO
3���㣬����μӴ˷�Ӧ��NO
2��O
2�������ӵõ�ԭ������������ΪNO���ȸ���3NO
2+H
2O=2HNO
3+2NO���������NO
2��Ȼ�����4NO
2+O
2+2H
2O=4HNO
3����μӴ˷�Ӧ��NO
2��O
2�������ӵõ�ԭ����NO
2�����ո���M=
��ƽ��Ħ��������ƽ����������Ħ����������ֵ����ȣ�
����⣺��1��Bװ��Ϊ��״������ˮ�Ĺ����Һ�巴Ӧ��ȡ�����װ�ã������ü��ȣ���ѧ��ѧ�г������У�H
2��CO
2��H
2S �ȣ��ʴ�Ϊ��H
2��CO
2��H
2S �ȣ�
��2��ʵ�����Ƶõ�����������������ˮ�������Ȼ������壬Ҫ���и�����������߱�Ư���Ե���֤���飬�ٽ���ʵ�����ܵõ����ۣ��Ȼ�����������ˮ�γ����ᣬ����Ҳ�ܺ�̼�����Ʒ�Ӧ����������̼���壬��һ����������ˮ��Ӧ�IJ�������ԣ��ʴ�Ϊ����������û������֤�������������Ư���ԣ��������� ��ȡ�������к���HCl���壬HCl����ˮ������̼�����Ʒ�ĩ��Ӧ�������ݣ�
��3����֤Cl
-��Br
-�Ļ�ԭ��ǿ���ɸ��ݷ�ӦCl
2+2Br
-=2Cl
-+Br
2���ʵ�飬��Aװ�����Ʊ����������ɵ�����ͨ�뵽װ���廯����Һ��C�У�����ƿ���л���ɫ�������ɣ��Թ�����Һ����ɫ��Ϊ��ɫ����֤��������������ǿ���壬
�ʴ�Ϊ���ڼס��ҡ����зֱ�װ��Ũ���ᡢ�������̡��廯����Һ����ƿ���л���ɫ�������ɣ��Թ�����Һ����ɫ��Ϊ��ɫ����֤��������������ǿ���壻
��4��Ũ�������ǿ�����ԣ���ͭ��Ӧ���ɶ����������壬��Ӧ�Ļ�ѧ����ʽΪCu+4HNO
3��Ũ���TCu��NO
3��
2+2NO
2��+2H
2O��
�ʴ�Ϊ��Cu+4HNO
3��Ũ���TCu��NO
3��
2+2NO
2��+2H
2O��
��5��Ũ������ͭ��Ӧ���ɵĶ��������ռ����Թܶ��У�װ����֤NO
2��ˮ�ķ�Ӧ��Ҫ�ȹر�a��b��Ȼ�����ȷ�ʹ�Թ��������ݳ���NO
2��ˮ�Ӵ��������ձ��е�ˮ�������Թܶ��У�
�ʴ�Ϊ��a��b��c��˫�ֽ��գ����ȣ��Թܶ���ʹ�Թ��������ݳ���NO
2��ˮ�Ӵ��������ձ��е�ˮ�������Թܶ��У�
��6��NO
2��O
2���������Թܵ�����ˮ�У�������Ӧ��4NO
2+O
2+2H
2O=4HNO
3 ���ʣ���������Ϊ������Ҳ������NO���壬��NO
2��O
2�����������ʵ���Ϊ10mol��
��ʣ������Ϊ��������μ�4NO
2+O
2+2H
2O=4HNO
3 ��Ӧ���ĵ�����Ϊx���������ĵ�NO
2Ϊ4x������5x=9mol��x=1.8mol��������Ϊ2.8mol��V��NO
2��=7.2mol��
��������������Ϊ7.2molNO
2��2.8molO
2������֮��Ϊ7.2mol��46g/mol+2.8mol��32g/mol=420.8g��ƽ��Ħ������
=42.08g/mol��ƽ��������42.08��
��ʣ������ΪNO���壬�Թ�9/10����ˮ����ʣ��1molNO������3NO
2+H
2O=2HNO
3+NO��˵��������NO
2Ϊ3mol����Ӧ4NO
2+O
2+2H
2O=4HNO
3���ĵ����������Ϊ7mol���跴Ӧ���ĵ�����Ϊy���������ĵ�NO
2Ϊ4y����5y=7mol��y=1.4mol������ʱ����Ϊ1.4mol��V��NO
2��=8.6mol��
��������������Ϊ8.6molNO
2��1.4molO
2������֮��Ϊ8.6mol��46g/mol+1.4mol��32g/mol=440.4g��ƽ��Ħ������
=44.04g/mol��ƽ��������44.04��
�ʴ�Ϊ��42.08��44.04��