
【题目】下列说法正确的是( )
A.由同种元素组成的物质一定是纯净物
B.不能跟酸反应的氧化物一定能跟碱反应
C.![]() 分子中既含有极性键也含有非极性键
分子中既含有极性键也含有非极性键
D.石油分馏、干冰升华、水的净化都只涉及物理变化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应A(s)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.v(C)=0.02mol·(L·s)-1B.v(B)=0.06mol·(L·min)-1
C.v(A)=1.5mol·(L·min)-1D.v(D)=0.01mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) H<0。
2SO3(g) H<0。
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:_______。
(2)某兴趣小组在实验室对该反应进行研究,在一密闭容器内加入一定量的SO2和O2,部分实验图像如图1

① 该反应的平衡常数表达式为___________________。
② t1、t2、t3中,达到化学平衡状态的是________________。
③ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________________。
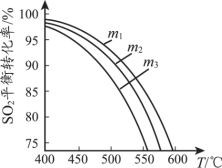
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m[m=n(SO2)/n(O2)] 不同时,SO2的平衡转化率与温度(T)的关系如图所示,则m1、m2、m3的从大到小的顺序为___________________。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH-)=_______mol·L1。将原料气SO2和O2通入该氨水中,当c(OH-)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=____。
)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁等,其流程如图所示。
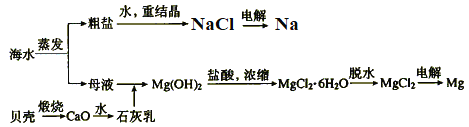
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
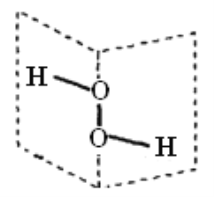
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH1 平衡常数为K2
FeO(s)+H2(g) ΔH1 平衡常数为K2
不同温度下,K1、K2的值如下表:

现有反应Ⅲ:H2(g)+CO2(g)![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是___(填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___(写出任意两条)。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___(填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___(写出任意两条)。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为______。
②图2中m1、m2、m3从大到小的顺序为____。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为____,T4温度时,该反应平衡常数KP的计算式为____。
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括____和H++HCO3- ==CO2↑+H2O
②简述CO32-在阴极区再生的原理:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
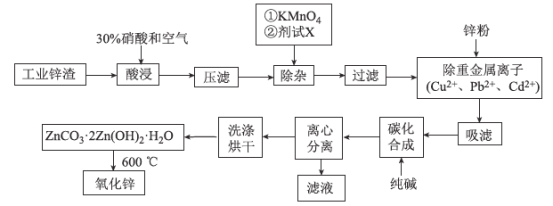
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
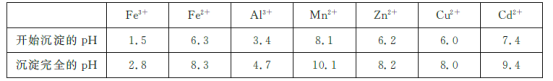
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
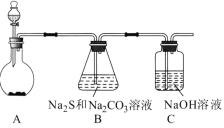
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
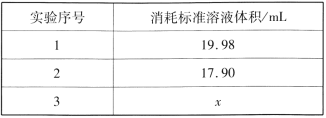
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com