
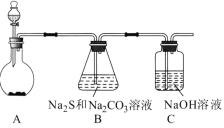
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
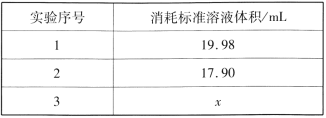
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。

【答案】![]() 2:1 二氧化硫融入过多使溶液呈酸性,而
2:1 二氧化硫融入过多使溶液呈酸性,而![]() 可以与氢离子反应,导致产量降低 蒸发浓缩 冷却结晶 溶液由无色变为蓝色,且半分钟颜色不退去 18.10 89.28%
可以与氢离子反应,导致产量降低 蒸发浓缩 冷却结晶 溶液由无色变为蓝色,且半分钟颜色不退去 18.10 89.28%
【解析】
装置A为二氧化硫的发生装置,装置B为硫代硫酸钠的制备装置,装置C为尾气处理装置。
(1)A为二氧化硫的发生装置,反应的化学方程式为![]() ;
;
(2)装置B中发生的反应为![]() ,为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为2:1;
,为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为2:1;
(3)硫代硫酸钠在酸性条件下会发生水解,二氧化硫过量会使溶液呈酸性,导致产品产量减少,所以二氧化硫不能过量;
(4)过滤B中的混合物,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O35H2O晶体;
(5)①滴定所用指示剂是淀粉溶液,当达到滴定终点时,碘稍过量,碘遇淀粉变蓝色;所以溶液会由无色变为蓝色;
②由滴定管的读数可知,开始的刻度是0.50mL,后来的读数是18.60mL,所用溶液的体积是18.10mL,即x=18.10mL,实验序号1所得的体积与另外两组相差较大,舍去,则消耗标准液的平均体积为18.00mL,则碘的物质的量是0.0180L×0.1000mol/L,根据碘与硫代硫酸钠反应的方程式可知硫代硫酸钠的物质的量是0.0180L×0.1000mol/L×2×10=0.036mol,所以产品的纯度为![]() ×100%=89.28%。
×100%=89.28%。


科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
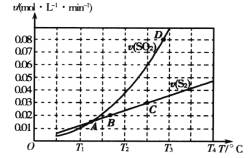
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求将相应序号填入空白中:
A.O2和O3
B.35Cl和37Cl
C.CH3CH2CH3和CH3CH2CH2CH3
D.H2和D2
E.CH3CH2CH2OH和CH3-O-CH2CH3
F.![]() C和
C和![]() N
N
(1)组两种微粒互为同位素___;
(2)组两种物质互为同素异形体___;
(3)组两种物质属于同系物___;
(4)组两物质互为同分异构体___;
(5)组两物质是同一物质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置___。
(2)D的最高价氧化物的水化物,所含化学键类型:___、___。
(3)B、C、D、E简单离子半径由大到小顺序为:___(填元素符号)。
(4)用电子式表示E的氢化物的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.双氰胺结构简式如图。
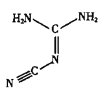
(1)双氰胺的晶体类型为_____。
(2)双氰胺所含元素中,_____(填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4
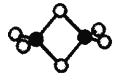
(4)乙硼烷分子中硼原子的杂化轨道类型为______。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____(填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____(填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
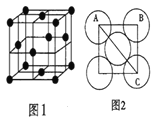
(7)晶体铝中原子的堆积方式为_____。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=___g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )

A.元素对应的离子半径:Z>X>R>W
B.简单氢化物的沸点:W>R>Y>Z
C.M、N、R、W的简单离子均能促进水的电离
D.Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
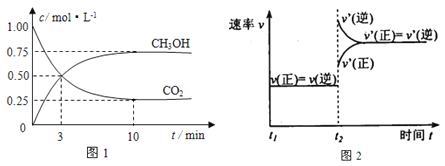
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为_______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为_______(保留两位小数),若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正)_____v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1:4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3:1
d.CO2的生成速率与CH3OH的生成速率相等
现测得CO2相CH3OH (g)的浓度随时间变化如图所示。
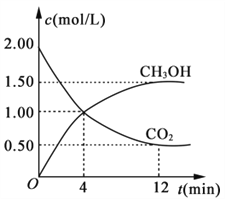
从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2 CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com