
【题目】I.双氰胺结构简式如图。
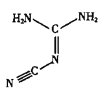
(1)双氰胺的晶体类型为_____。
(2)双氰胺所含元素中,_____(填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4
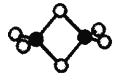
(4)乙硼烷分子中硼原子的杂化轨道类型为______。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____(填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____(填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
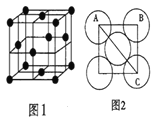
(7)晶体铝中原子的堆积方式为_____。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=___g·cm-3(用含a、M、NA的代数式来表示)。
【答案】分子晶体 氮 9:3或3:1 sp3 D、E Li<B<H 面心立方堆积 ![]()
【解析】
(1)根据双氰胺结构简式可知,双氰胺由分子构成;
(2)根据洪特规则分析未成对电子数;
(3)单键全是σ键,双键中有1个σ键、一个π键,叁键中有1个σ键、两个π键;
(4)根据乙硼烷球棍模型可知,乙硼烷分子中1个硼原子形成4个单键;
(5)B、H都是非金属元素的原子, B原子最外层有3个电子;
(6)化合物中电负性强的元素一般显负价;
(7)根据金属铝的晶胞图,顶点、面心各有1个铝原子;
(8)根据![]() =晶胞的摩尔质量÷(1个晶胞的体积×NA)计算;
=晶胞的摩尔质量÷(1个晶胞的体积×NA)计算;
(1)双氰胺由分子构成,属于分子晶体;
(2)根据洪特规则,C、H、N未成对电子数分别2、1、3,未成对电子数最多的元素是氮元素;
(3)单键全是σ键,双键中有1个σ键、一个π键,叁键中有1个σ键、两个π键,根据双氰胺结构简式 可知,σ键和π键数目之比为3:1;
可知,σ键和π键数目之比为3:1;
(4)乙硼烷分子中1个硼原子形成4个单键,所以乙硼烷分子中硼原子的杂化轨道类型为sp3;
(5)B、H都是非金属元素的原子, B原子最外层有3个电子,所以LiBH4中硼原子和氢原子之间形成4个极性共价键,其中有一个是配位键,故选D、E;
(6)电负性强的元素一般显负价,LiBH4中H为-1价,同周期元素从左到右电负性增大,所以电负性从小到大的顺序为Li<B<H;
(7)根据金属铝的晶胞图可知,晶体铝中原子的堆积方式为面心立方堆积;
(8)根据均摊原则,晶胞中铝原子数是![]() ,所以晶胞的摩尔质量是4×Mg/mol;铝原子半径为a cm,则边长为
,所以晶胞的摩尔质量是4×Mg/mol;铝原子半径为a cm,则边长为![]() cm,晶胞体积为
cm,晶胞体积为![]() ,晶胞密度为(4×M)÷(
,晶胞密度为(4×M)÷(![]() ×NA)=
×NA)=![]() g·cm-3。
g·cm-3。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为____。
(2)上述反应中的氧化剂是____,反应产生的气体可用_____吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,则反应中转移电子的数目为____。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量___(填字母)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___(填“高”或“低”),其判断理由是______。
(2)铜原子在基态时的价电子排布式为______。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____。某同学所画基态镁原子的核外电子排布图如图![]() ,该同学所画的电子排布图违背了______。
,该同学所画的电子排布图违背了______。
(4)K元素处于元素周期表的____区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是( )
A. 反应后的固体混合物中还含有碳
B. 反应后的固体混合物中Cu的质量为12.8 g
C. 反应后的固体混合物总质量为14.4 g
D. 反应后的固体混合物中氧化物的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
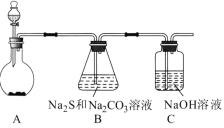
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。

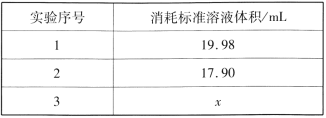
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂硫电池的总反应为2Li+xS===Li2Sx。以锂硫电池为电源,通过电解含(NH4)2SO4 的废水制备硫酸和化肥的示意图如图 (不考虑其他杂质离子的反应)。下列说法正确的是

A. b为电源的正极
B. 每消耗32 g硫,理论上导线中一定通过2 mol e-
C. SO42-通过阴膜由原料室移向M室
D. N室的电极反应式为2H2O-4e-===O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀醋酸,各加入生铁块,放置一段时间。下列有关描述错误的是

A. 生铁块中的碳是原电池的正极
B. 两试管中相同的电极反应式是:Fe-2e- = Fe2+
C. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D. 红墨水柱两边的液面变为左低右高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.①甲烷 ②乙烷 ③丙烷 ④丁烷的沸点由高到低的顺序为____(用序号表示);CH3CH2CH2CH3的一氯代物有__种。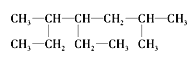 的名称为_______
的名称为_______
II. 现有下列物质:①CH4 ②CH2=CH2 ③CH3CH2CH2CH3 ④(CH3)2CHCH3
(1)与①互为同系物的是__________(填序号)
(2)写出③的同分异构体的结构简式______________________________;
(3)写出①与氯气反应生成CH3Cl的化学方程式________________________________;
(4)写出②发生加聚反应生成聚乙烯的化学方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com