
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
【答案】B
【解析】
本题A、B、C选项应区分电离和电解的概念。电离是电解质溶于水或熔融状态下,解离成能够自由移动的离子的过程。根据其电离程度可分为强电解质和弱电解质,几乎全部电离的是强电解质(如A选项),只有少部分电离的是弱电解质(如C选项);是将电能转化为化学能的一个装置(构成:外加电源,电解质溶液,阴阳电极)。使电流通过电解质溶液或熔融电解质而在阴,阳两极引起还原氧化反应的过程(如B选项)。
A.NaCl为强电解质,NaCl溶于水,NaCl在水分子作用下,自发解离为Na+和Cl-,故电离方程式为NaCl=Na++Cl-,故A不符合题意;
B.电解氯化铜溶液,铜离子向阴极移动,得电子,发生电极反应为:Cu2++2e-=Cu,氯离子向阳极移动,失电子,发生电极反应为:2Cl-+2e-=Cl2,所以电解总反应为:Cu2++2Cl-![]() Cu+Cl2,故B符合题意;
Cu+Cl2,故B符合题意;
C.CH3COOH为弱电解质,溶于水部分电离,因此电离方程式为CH3COOH![]() CH3COO-+H+,故C不符合题意;
CH3COO-+H+,故C不符合题意;
D.由图可知,反应H2(g)+Cl2(g)=2HCl(g)的反应热等于断裂反应物分子中的化学键吸收的总能量(436kJ/mol+243kJ/mol=679kJ/mol),与形成生成物分子中化学键放出的总能量(431kJ/mol×2=862kJ/mol)之差,即放热183kJ/mol,放热H为负值,所以H2(g)+Cl2(g)=2HCl(g)H=-183kJ/mol,故D不符合题意;
综上所述,本题应选B。


科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容容器中投入一定量纯净的氨基甲酸铵,发生下列反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员最近发明了一种水电池,这种电池能利用淡水和海水之间的含盐量差进行供电,该电池的化学反应为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)简述Na2O熔点比NaCl高的其原因。_______________________
(2)将Al粉和MnO2混合,经高温引发反生反应,写出化学反应方程式。__________________________,若反应中生成5.5kg单质,则转移电子的数目是________个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X的化学式可能是________________、________________。
(4)将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,请写出离子方程式。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP(F)是一种用于生产医疗器械和食品包装袋的原料,可以由芳香烃为原料制备而得:
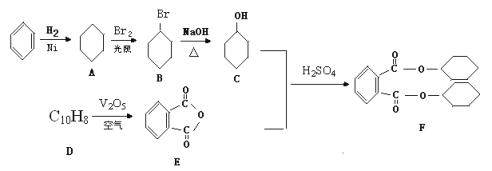
(1)D的结构简式是_________,D→E的反应类型为_______________。
(2)鉴别苯酚![]() 和化合物C
和化合物C![]() 的试剂为___________。
的试剂为___________。
(3)C的同系物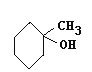 (G)根据系统命名法名称为____________,若化合物M是G的同分异构体,且分子中核磁共振氢谱显示有2个吸收峰(一氯代物只有两种),写出该化合物的结构简式是_________。(任写一种)
(G)根据系统命名法名称为____________,若化合物M是G的同分异构体,且分子中核磁共振氢谱显示有2个吸收峰(一氯代物只有两种),写出该化合物的结构简式是_________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为MnO2和浓盐酸共热制取氯气的实验装置,反应为:MnO2+4HCl![]() MnCl2+Cl2+2H2O,请回答下列问题:
MnCl2+Cl2+2H2O,请回答下列问题:

(1)打开活塞K,将分液漏斗中的液体加入烧瓶中,观察D中导管口是否有气泡产生,__(填:能或不能)验证装置的气密性良好;
(2)C中收集到的Cl2中含有HCl,请从分子结构的角度解释其中的原因___;
(3)装置D的作用是___;
(4)B的作用为___(选填下列编号)。
A.洗气瓶 B.储气瓶 C.安全瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20 mL 18.4 mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100 mL,测得SO42-离子物质的量浓度为3. 18 mol/L。试求溶液中CuSO4的物质的量浓度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
I.采样
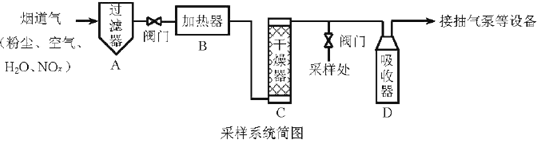
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140。C;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
II. NOx含量的测定
将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)NO被H2O2氧化为NO3-的离子方程式是___________。
(2)滴定操作使用的玻璃仪器主要有___________。
(3)滴定过程中发生下列反应:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m-3。
(4)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果___________。若FeSO4标准溶液部分变质,会使测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如图:
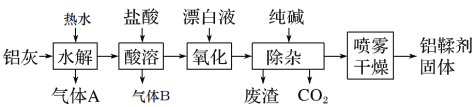
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90℃时水解生成A的化学方程式为:__,“水解”采用90℃而不在室温下进行的原因是___。
(2)“酸溶”时,生成气体B的离子方程式为___。
(3)“氧化”时反应的离子方程式为___。
(4)“除杂”中反应的离子方程式为__。
(5)“喷雾干燥”是将需干燥的物料,分散成很细的像雾一样的微粒,与热空气接触,在瞬间将大部分水分除去,使物料中的固体物质干燥成粉末。采用喷雾干燥而不用蒸发可有效防止产品的水解或分解,写出Al(OH)2Cl在较高温度下分解的化学方程式___。“喷雾干燥”中将需干燥的物料,分散成很细的微粒的目的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com