
【题目】美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO![]() 和NH
和NH![]() B.H3O+和ClO
B.H3O+和ClO![]()
C.NO![]() 和CO
和CO![]() D.PO
D.PO![]() 和SO
和SO![]()
【答案】C
【解析】
离子中所有原子都在同一平面上,则离子的空间构型为直线形、V形或平面三角形,根据中心原子的价层电子对数判断分子的空间构型,价层电子对=σ 键电子对+中心原子上的孤电子对,据此分析。
A.NO2-中心原子的价层电子对数=2+(5+1-2×2)×![]() =3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+(5-1-4×1)×
=3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+(5-1-4×1)×![]() =4,没有孤电子对,空间构型为正四面体,故A不符合题意;
=4,没有孤电子对,空间构型为正四面体,故A不符合题意;
B.H3O+中心原子的价层电子对数=3+(6-1-3×1)×![]() =4,含有一个孤电子对,空间构型为三角锥形,ClO3-中心原子的价层电子对数=3+(7+1-3×2)×
=4,含有一个孤电子对,空间构型为三角锥形,ClO3-中心原子的价层电子对数=3+(7+1-3×2)×![]() =4,含有一个孤电子对,空间构型为三角锥形,故B不符合题意;
=4,含有一个孤电子对,空间构型为三角锥形,故B不符合题意;
C.NO3-中心原子的价层电子对数=3+(5+1-3×2)×![]() =3,没有孤电子对,空间构型为平面三角形,CO32-中心原子的价层电子对数=3+(4+2-2×3)×
=3,没有孤电子对,空间构型为平面三角形,CO32-中心原子的价层电子对数=3+(4+2-2×3)×![]() =3,没有孤电子对,空间构型为平面三角形,故C符合题意;
=3,没有孤电子对,空间构型为平面三角形,故C符合题意;
D.PO43-中心原子的价层电子对数=4+(5+3-4×2)×![]() =4,没有孤电子对,空间构型为正四面体,SO42-中心原子的价层电子对数=4+(6+2-4×2)×
=4,没有孤电子对,空间构型为正四面体,SO42-中心原子的价层电子对数=4+(6+2-4×2)×![]() =4,没有孤电子对,空间构型为正四面体,故D不符合题意;
=4,没有孤电子对,空间构型为正四面体,故D不符合题意;
答案为C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
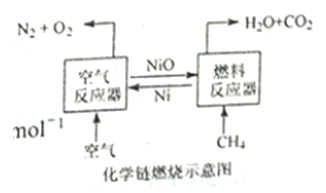
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C.H两种元素组成;②球棍模型为 |
C | ①由C.H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C.H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___;反应类型___。
(2)B具有的性质是___(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)C所含官能团的名称是___,D所含官能团的名称是___,C和D发生酯化的反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述正确的是( )
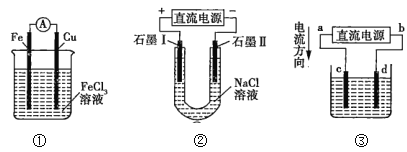
A.装置①是原电池,总反应是Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为Fe3++e-=Fe2+
C.装置②通电,两个石墨电极上都有气体产生
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
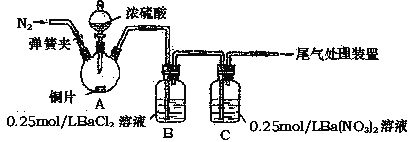
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图象的说法中,不正确的是![]()
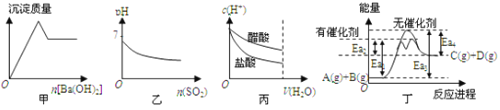
A.甲是向![]() 溶液滴加
溶液滴加![]() 时,沉淀质量与
时,沉淀质量与![]() 物质的量的关系图
物质的量的关系图
B.乙是向溴水通入![]() 气体时,pH与
气体时,pH与![]() 物质的量的关系图
物质的量的关系图
C.丙是向![]() 相同的醋酸和盐酸滴入水时,
相同的醋酸和盐酸滴入水时,![]() 与水体积的关系图
与水体积的关系图
D.由丁可知,A与B在有催化剂存在的热化学方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
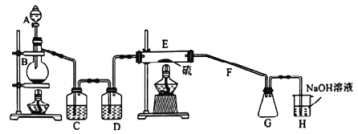
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com