
【题目】关于如图所示各装置的叙述正确的是( )
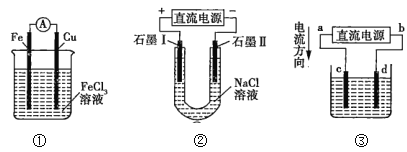
A.装置①是原电池,总反应是Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为Fe3++e-=Fe2+
C.装置②通电,两个石墨电极上都有气体产生
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
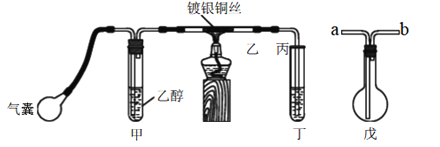
(1)甲装置常常浸在70~80℃的水浴中,目的是____________________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在___________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
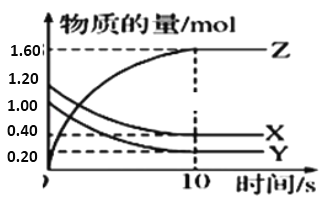
(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____ 。
(3)10s时,该反应 ___ 达到了化学平衡状态。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用反应2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH检测乙醇。下列说法错误的是( )
A.基态Cr3+的核外电子排布式为3d3
B.[Cr(H2O)6]3+中与Cr3+形成配位键的原子是氧原子
C.CH3COOH分子中含有7个![]() 键
键
D.已知CrO42-是以Cr为中心的四面体结构,则Cr2O72-结构中含有两个四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
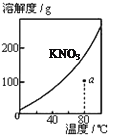
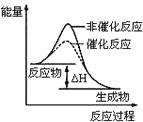

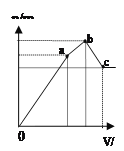
图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示反应aA(g)+bB(g)![]()
![]() cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO![]() 和NH
和NH![]() B.H3O+和ClO
B.H3O+和ClO![]()
C.NO![]() 和CO
和CO![]() D.PO
D.PO![]() 和SO
和SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K(300℃)>K(350℃),该反应是____热反应。
(2)如图中表示NO2浓度变化曲线的是__(填序号),用O2表示从0~2 s内该反应的平均速率v=___。
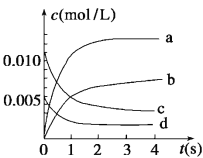
(3)能说明该反应已经达到平衡状态的是__(填字母序号)。
a.c(NO2)=2c(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___(填字母序号)。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
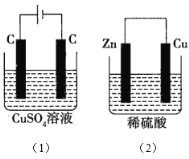
A.产生气体的物质的量:(1)> (2)
B.电极上析出物质的质量:(1)> (2)
C.溶液pH的变化:(1)增大,(2)减小
D.电极反应式:(1)中阳极的电极反应式为4OH--4e-=2H2O+O2↑,(2)中负极的电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式: ________________ 。
(2)用电子排布图表示D元素原子的价电子:__________。
(3)元素B与D的电负性的大小关系是B___ D (填“>”“<”或“=”,下同), E与C的第一电离能大小关系是E____C。
(4)写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com