
【题目】图中所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
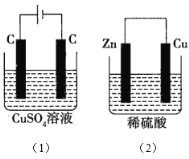
A.产生气体的物质的量:(1)> (2)
B.电极上析出物质的质量:(1)> (2)
C.溶液pH的变化:(1)增大,(2)减小
D.电极反应式:(1)中阳极的电极反应式为4OH--4e-=2H2O+O2↑,(2)中负极的电极反应式为2H++2e-=H2↑
【答案】B
【解析】
根据离子的放电顺序可知,(1)中电解池的总反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,根据原电池原理,(2)中电池的总反应方程式为Zn+H2SO4=ZnSO4+H2↑。
2Cu+O2↑+2H2SO4,根据原电池原理,(2)中电池的总反应方程式为Zn+H2SO4=ZnSO4+H2↑。
A.线路中转移电子为0.02mol,则(1)、(2)产生气体的物质的量分别为0.005molO2、0.01molH2,(1)<(2),A错误;
B.(1)析出物质为0.01molCu和0.005molO2,(2)析出物质为0.01molH2,则电极上析出物质的质量:(1)> (2),B正确;
C.电池反应发生后,(1)中酸性增强,(2)中酸性减弱,则溶液pH:(1)减小,(2)增大,C错误;
D.电极反应式:(1)中阳极的电极反应式为2H2O-4e-=O2↑+4H+,(2)中负极的电极反应式为Zn-2e-=Zn2+,D错误;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
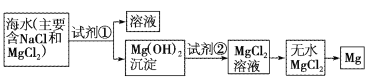
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述正确的是( )
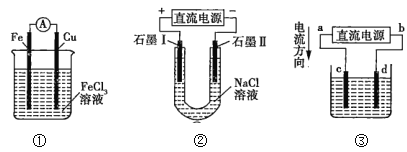
A.装置①是原电池,总反应是Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为Fe3++e-=Fe2+
C.装置②通电,两个石墨电极上都有气体产生
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)紫杉醇![]() 是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如下
是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如下![]() 图示中结构
图示中结构![]() 为苯基
为苯基![]() :
:
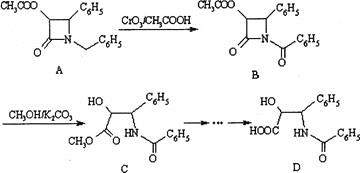
![]() 下列说法不正确的是________。
下列说法不正确的是________。
A.有机物A的分子式是![]()
B.有机物A和B结构中具有相同的官能团
C.有机物D能发生的有机反应类型有酯化、水解、加成、消去和缩聚反应
D.上述四种有机物在酸性条件下均能发生水解反应,且都能得到同一种水解产物
![]() 的合成应用了2010年诺贝尔化学奖的获奖成果
的合成应用了2010年诺贝尔化学奖的获奖成果![]() 交叉偶联反应,反应式如下
交叉偶联反应,反应式如下![]() 已配平
已配平![]() :
:![]()
![]()
![]()
X分子中含碳氮双键![]() ,其结构简式为________。
,其结构简式为________。
![]() 已知酯和酰胺在过量醇中能发生醇解反应:
已知酯和酰胺在过量醇中能发生醇解反应:
CH3COOC2H5+CH3OH![]() CH3COOCH3+C2H5OH
CH3COOCH3+C2H5OH
![]() +CH3OH
+CH3OH![]()
![]() +CH3COOCH3
+CH3COOCH3
写出B转化为C的化学方程式是________。
![]() 若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F。写出同时符合下列条件的E的所有同分异构体的结构简式________。
若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F。写出同时符合下列条件的E的所有同分异构体的结构简式________。
①结构中含有![]()
②遇氯化铁溶液发生显色反应
③1H-NMR谱显示分子中有四种不同化学环境的氢原子
![]() 已知:
已知:
①RCHO![]()
![]()
②R’COOH![]() R’COCl
R’COCl
采用甲醛和乙醛为原料制备![]() ,请设计合成路线_____________。
,请设计合成路线_____________。![]() 无机试剂任选
无机试剂任选![]() 。合成路线流程图示例如下:
。合成路线流程图示例如下:
CH3CH2OH![]() H2C=CH2
H2C=CH2![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图象的说法中,不正确的是![]()
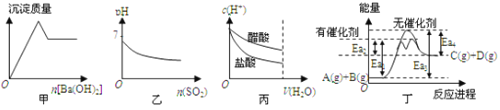
A.甲是向![]() 溶液滴加
溶液滴加![]() 时,沉淀质量与
时,沉淀质量与![]() 物质的量的关系图
物质的量的关系图
B.乙是向溴水通入![]() 气体时,pH与
气体时,pH与![]() 物质的量的关系图
物质的量的关系图
C.丙是向![]() 相同的醋酸和盐酸滴入水时,
相同的醋酸和盐酸滴入水时,![]() 与水体积的关系图
与水体积的关系图
D.由丁可知,A与B在有催化剂存在的热化学方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、C1-)生产CuCl的流程:
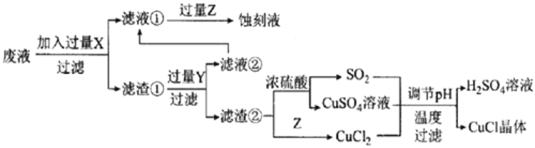
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为____________________________________________。
(2)滤液①需要加过量Z,检验Z过量的方法是______________________。
(3)写出生成CuCl的离子方程式:_________________________________。
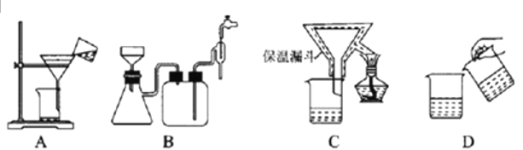
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置图中的___________(填选项字母),过滤后,洗涤CuCl的试剂宜选用___________(填“无水乙醇”或“稀硫酸”)
(5)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl2-,在一定温度下建立两个平衡:
I. CuCl (s) ![]() Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
II. CuCl(s)+Cl- (aq)![]() CuCl2-(aq) K=0.35。
CuCl2-(aq) K=0.35。
分析c(Cu+)、c(CuCl2-)和Ksp、K的数学关系,在图中画出c(Cu+)、c(CuCl2-)的关系曲线(要求至少标出一个坐标点) ______。

(6)氯化亚铜的定量
①称取样品0.25g于250mL锥形瓶中,加入10mL过量的FeCl3溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用0.1000mol·L-1硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为24.30mL。
上述相应化学反应为CuCl+ FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+,则样品中CuCl的纯度为___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将正确答案的序号填在空白处。
(1)用经![]() 消毒的自来水配制下列溶液:①
消毒的自来水配制下列溶液:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ;⑤
;⑤![]() ;⑥稀盐酸,发现部分药品变质,它们是 ______ 。
;⑥稀盐酸,发现部分药品变质,它们是 ______ 。
(2)下列反应必须加入氧化剂且一步反应就能完成的是 ______ 。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(3)在如图所示的8个装置中,属于原电池的是 ______ 。
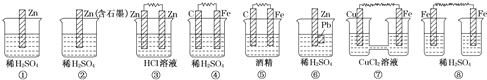
(4) ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
②③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少.
据此判断这四种金属活动性由大到小的顺序是 ______ 。
(5)下列物质中,不能由单质直接化合生成的是 ______ 。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(6)下列物质中,属于强电解质的是 ______ ;属于非电解质的是 ______ 。
①氨气②氨水③盐酸④醋酸⑤硫酸钡⑥氯化银 ⑦氯化钠⑧二氧化碳⑨醋酸铵⑩氢气![]() 水
水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2NO2(g)![]() 2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO):c(O2)=2:1
D.混合气体的颜色不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com