
【题目】某物质只含C. H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等)。
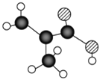
(1)该物质的结构简式为_________;
(2)该物质中所含官能团的名称为_________、_________;
(3)下列物质中,与该产品互为同分异构体的是______(填序号);与该产品互为同系物的是(填序号)________;
①CH3CH═CHCOOH ②CH2═CHCOOCH3 ③CH3CH2CH═CHCOOH ④CH3CH(CH3)COOH.
(4)下列对该物质性质的说法中,不正确的是_________。
A.它能使酸性高锰酸钾褪色 B.它能发生加成反应 C.它能发生酯化反应 D.它能发生水解反应
【答案】![]() 碳碳双键 羧基 ①② ③ D
碳碳双键 羧基 ①② ③ D
【解析】
某物质只含C、 H、O三种元素,其分子模型为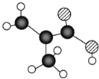 ,则
,则![]() 代表碳原子、
代表碳原子、![]() 代表氧原子、
代表氧原子、![]() 代表氢原子。按碳形成4个共价键,氧形成2个共价键,氢形成1个共价键的原则,可确定原子间形成的共价键为单键还是双键。
代表氢原子。按碳形成4个共价键,氧形成2个共价键,氢形成1个共价键的原则,可确定原子间形成的共价键为单键还是双键。
(1)由以上分析,可确定该物质的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(2)该物质中所含官能团的名称为碳碳双键、羧基。答案为:碳碳双键;羧基;
(3) ![]() 与CH3CH═CHCOOH和CH2═CHCOOCH3分子式都为C4H6O2,但结构不同,三者互为同分异构体,故选①②;
与CH3CH═CHCOOH和CH2═CHCOOCH3分子式都为C4H6O2,但结构不同,三者互为同分异构体,故选①②;![]() 与CH3CH2CH═CHCOOH都为烯酸,官能团的种类和数目都相同,且分子组成上相差1个“CH2”,二者互为同系物,故选③。答案为:①②;③;
与CH3CH2CH═CHCOOH都为烯酸,官能团的种类和数目都相同,且分子组成上相差1个“CH2”,二者互为同系物,故选③。答案为:①②;③;
(4) A.![]() 分子中含有碳碳双键,能使酸性高锰酸钾褪色,A不合题意;
分子中含有碳碳双键,能使酸性高锰酸钾褪色,A不合题意;
B.![]() 分子中含有碳碳双键,能发生加成反应,B不合题意;
分子中含有碳碳双键,能发生加成反应,B不合题意;
C.![]() 分子中含有羧基,能发生酯化反应,C不合题意;
分子中含有羧基,能发生酯化反应,C不合题意;
D.![]() 不能发生水解反应,D符合题意;
不能发生水解反应,D符合题意;
故选D。答案为:D。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质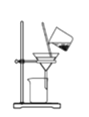
C.制备Cl2,并将I-氧化为I2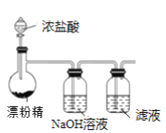
D.以淀粉为指示剂,用Na2SO3标准溶液滴定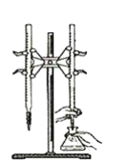
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业会产生大量的电镀污水处理电镀污水时会产生大量的电镀污泥,电镀污泥含有多种金属(Ni、Cu、Fe、Cr、Al)的氢氧化物和不溶性杂质。下面是处理某种电镀污泥回收铜、镍元素的一种工业流程:

电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表。
![]()
(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有___________(写出两条)。
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为___________。
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中PO43-浓度不能超过________ mol/ L。(列出计算表达式.Ksp[Ni3(PO4)2]=5×10-31)
(4)滤液中的___________可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为________ (用离子方程式解释)。
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为________。
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeSO4,在酸性条件下Cr2O72-被还原为Cr3+,同时生成Fe3+;加入过量的强碱生成铁铬氧体(CrxFe3-xO4沉淀,写出加入过量强碱生成铁铬氧体(CrxFe3-xO4)沉淀的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如下图所示,关于该物质的下列说法不正确的是
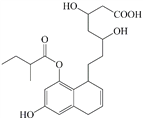
A. 遇FeCl3溶液发生显色反应
B. 能发生取代、消去、加成反应
C. 1 mol该物质最多能与4mol Br2反应
D. 1 mol 该物质最多能与4 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
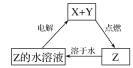
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)![]() N2O4(g), 升高温度平衡体系颜色变深
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多金属元素都能以硫化物的形式存在,硫铁矿(FeS2)就是其中一种,在矿区,开采出的硫铁矿石暴露在空气和水中,会发生下图所示转化。回答下列问题:

⑴FeS2的氧化产物Fe2(SO4)3易______,会使地下水和土壤呈______性;如果矿区中的水流或降雨不断淋洗硫铁矿,FeS2最终转化为____________。
⑵写出FeS2的电子式:____________。
⑶写出图中①③两个反应的离子方程式:
①____________________________________,
③____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
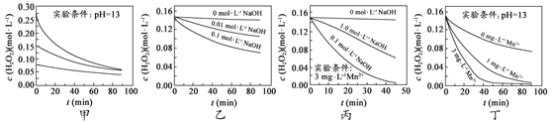
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com